题目内容
5.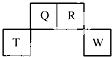 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
(1)T的原子结构示意图为
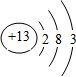 .
.(2)元素的非金属性为(原子的得电子能力):Q弱于W(填“强于”或“弱于”).
(3)Q的单质与W最高价氧化物的水化物浓溶液共热能发生反应,反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
(4)原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(5)R有多种氧化物,其中甲的相对分子质量最小.通常情况下,甲遇到空气即可转变成一种红棕色的气体乙,甲、乙分别是NO和NO2(填化学式).
分析 这几种都是短周期元素,T所处的周期序数与主族序数相等,T位于第三周期,则T是Al元素,根据它们的位置知,Q是C、R是N、W是S元素,由此分析解答.
解答 解:(1)T的原子是铝原子,铝的原子序数为13,核外有3个电子层,最外层电子数为3,其原子结构示意图为: ,故答案为:
,故答案为: ;
;
(2)元素最高价氧化物对的水化物的酸性越强,其非金属性越强,Q是C对应的碳酸、W是S元素对的硫酸是强酸,所以硫的非金属性强于碳,故答案为:弱于;
(3)Q的单质是碳与W最高价氧化物的水化物浓溶液是浓硫酸,两者共热发生氧化还原反应生成二氧化碳、二氧化硫和水,方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(4)原子序数比R多1的是氧元素,一种氢化物能分解为它的另一种氢化物,即是过氧化氢分解生成水和氧气,所以反应方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,故答案为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(5)R有多种氧化物,其中甲的相对分子质量最小是一氧化氮,通常情况下,甲遇到空气即可转变成一种红棕色的气体乙是二氧化氮,故答案为:NO;NO2.
点评 本题考查了元素周期表和元素周期律综合应用,根据物质的性质结合元素周期律解答,注意化学方程式的书写.

练习册系列答案
相关题目
16.下列有关物质用途的说法正确的是( )
| A. | 氯气可用于自来水消毒 | B. | 甲醛可用作食品防腐剂 | ||
| C. | 碳酸钠可用来治疗胃酸过多 | D. | 铝制容器可长期存放碱性物质 |
20.已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如下图所示.下列说法正确的是( )
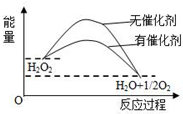

| A. | 加入催化剂,减小了反应的热效应 | |
| B. | 加入催化剂,可提高H2O2的平衡转化率 | |
| C. | H2O2分解的热化学方程式:H2O2=H2O+$\frac{1}{2}$O2+Q | |
| D. | 反应物的总能量高于生成物的总能量 |
10.用石墨棒作阳极、铁棒作阴极电解熔融的氯化钠,下列说法中正确的是( )
| A. | 石墨周围有大量的Na+ | |
| B. | 铁棒质量增加 | |
| C. | 电子通过电解质溶液由石墨棒流向铁棒 | |
| D. | 铁棒电极发生氧化反应 |
17.下列表述中正确的是( )
| A. | NH5的电子式为: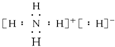 | |
| B. | 分馏、干馏、裂化都是化学变化 | |
| C. | 2-甲基-1-丁烯的结构简式: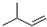 | |
| D. | NaHSO4和Na2O2的阴、阳离子个数比均为1:2 |
14.已知A、B、C、D、E是短周期中原子序数依次增大的5种元素,B、C同周期,D、E也同周期,D原子最外层电子数与最内层电子数相等,A、B、C、D的原子序数之和是E的两倍,D与C形成的化合物是一种耐高温材料,A、B形成的气态化合物的水溶液呈碱性.下列说法正确的是( )
| A. | A、B、C三种元素形成的化合物中肯定只含共价键 | |
| B. | A、C形成的化合物中只有A-C键 | |
| C. | 工业上生产单质D可用海水作原料获得 | |
| D. | 化合物DC与化合物EC2中化学键类型相同 |
15.硅是无机非金属材料的主角,硅芯片的使用,促进了信息技术的革命.
(1)陶瓷、水泥和玻璃都属于传统硅酸盐材料.其中,生产普通玻璃的主要原料除了SiO2、Na2CO3外还CaCO3.玻璃制作过程中发生了Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2的反应,碳酸酸性强于硅酸,但为什么该反应可在高温下发生?高温下Na2SiO3的稳定性比Na2CO3强.
(2)工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如图:
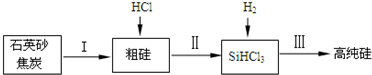
①请写出反应Ⅱ、Ⅲ的化学方程式:ⅡSi+3HCl$\frac{\underline{\;\;△\;\;}}{\;}$SiHCl3+H2、ⅢSiHCl3+H2$\frac{\underline{\;高温\;}}{\;}$Si+3HCl;
②在流化床反应的产物中,SiHCl3大约占85%,所含有的其它物质的沸点数据如下表:
提纯SiHCl3的主要工艺操作依次是沉降、冷凝和分馏(相当于多次蒸馏).沉降是为了除去Si;在空气中冷凝所得液体主要含有SiCl4、SiHCl3;若在实验室进行分馏提纯液体,应该采取以下加热方法中的D;
A.电炉加热 B.酒精灯加热 C.砂浴加热 D.水浴加热
③SiHCl3极易水解,其完全水解时的反应方程式为SiHCl3+4H2O=H4SiO4+H2↑+3HCl.
(1)陶瓷、水泥和玻璃都属于传统硅酸盐材料.其中,生产普通玻璃的主要原料除了SiO2、Na2CO3外还CaCO3.玻璃制作过程中发生了Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2的反应,碳酸酸性强于硅酸,但为什么该反应可在高温下发生?高温下Na2SiO3的稳定性比Na2CO3强.
(2)工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如图:

①请写出反应Ⅱ、Ⅲ的化学方程式:ⅡSi+3HCl$\frac{\underline{\;\;△\;\;}}{\;}$SiHCl3+H2、ⅢSiHCl3+H2$\frac{\underline{\;高温\;}}{\;}$Si+3HCl;
②在流化床反应的产物中,SiHCl3大约占85%,所含有的其它物质的沸点数据如下表:
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
A.电炉加热 B.酒精灯加热 C.砂浴加热 D.水浴加热
③SiHCl3极易水解,其完全水解时的反应方程式为SiHCl3+4H2O=H4SiO4+H2↑+3HCl.


 ;其反应类型是消去反应.
;其反应类型是消去反应.