题目内容
1.氰化钾是一种由剧毒的物质,贮存和使用时必须注意安全.已知:KCN+H2O2=KOCN+H2O,回答下列问题:(1)OCN-中所含三种元素的第一电离能从大到小的顺序为N>O>C(用盐酸符号表示,下同),电负性从大到小的顺序为O>N>C,基态氮原子外围电子排布式为2s22p3.
(2)H2O2中的共价键类型为σ键(填“σ键”或“π键”),其中氧原子的杂化轨道类型为sp3;分子中4个原子不在(填“在”或“不在”)同一条直线下;H2O2易溶于水除它们都是极性分子外,还因为H2O2分子与H2O分子间可形成氢键.
(3)与OCN-键合方式相同且互为等电子体的分子为CO2(或N2O)(任举一例);在与OCN-互为等电子体的微粒中,由N元素组成的阴离子是N3-.
分析 (1)同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA族和第VA族元素的第一电离能大于相邻元素;同周期自左而右电负性增大;氮原子的核电荷数为7,其2S、2P电子为其外围电子,根据能量最低原理书写其外围电子排布式;
(2)双键中1个为σ键,1个为π键,而O-H、O-O键为σ键;由H2O2的结构可知,O原子形成1个O-H键、1个O-O键,含有2对孤对电子,杂化轨道数为4,杂化方式为sp3;H2O2易溶于水,还因为H2O2分子与H2O分子间可形成氢键;
(3)原子个数相等且价电子数相等的分子或离子为等电子体.
解答 解:(1)C、N、O属于同一周期元素且原子序数依次减小,同一周期元素的第一电离能随着原子序数的增大而增大,但第ⅤA族的大于第ⅥA族的,所以其第一电离能大小顺序是N>O>C,同周期自左而右电负性增大,故电负性:O>N>C,氮原子的核电荷数为7,核外电子排布式为1s22s22p3,其外围电子排布式是2s22p3,
故答案为:N>O>C;O>N>C;2s22p3;
(2)H2O2为共价化合物,分子中存在两个氧氢键和一个O-O键,电子式为: ,O-H、O-O键都为σ键,由H2O2的结构可知,O原子形成1个O-H键、1个O-O键,含有2对孤对电子,杂化轨道数为4,杂化方式为sp3,水为极性分子,H2O2与水互溶,极性分子易溶于极性分子中,H2O2分子中羟基上,氢原子与另一个分子的氧原子能形成氢键,
,O-H、O-O键都为σ键,由H2O2的结构可知,O原子形成1个O-H键、1个O-O键,含有2对孤对电子,杂化轨道数为4,杂化方式为sp3,水为极性分子,H2O2与水互溶,极性分子易溶于极性分子中,H2O2分子中羟基上,氢原子与另一个分子的氧原子能形成氢键,
故答案为:σ键;sp3;不在;H2O2分子与H2O分子间可形成氢键;
(3)OCN-含有3个原子,价电子总数为6+4+5+1=16,故其等电子体为CO2(或N2O)等,在与OCN-互为等电子体的微粒中,由氮元素组成的阴离子是N3-,
故答案为:CO2(或N2O);N3-.
点评 本题考查了有关物质结构有关知识,掌握第一电离能、电负性、共价键、等电子体等知识是解答关键,题目难度中等.

| A. | 氢氧化钠的醇溶液,加热 | B. | 氢氧化钠的水溶液,加热 | ||
| C. | 酯、稀硫酸,加热 | D. | 银氨溶液 |
| A. | SO2可使石蕊试液褪色 | B. | SO2有漂白和杀菌作用 | ||
| C. | SO2溶于水后生成H2SO4 | D. | SO2是一种大气污染物 |
| A. | Cl2在反应中不一定只作氧化剂 | |
| B. | 在氧化还原反应中,1mol Cl2一定得到 2 mole- | |
| C. | 用pH试纸测得某饱和氯水的pH=2.3 | |
| D. | 除去HCl气体中的Cl2,可将气体通过盛饱和食盐水的洗气瓶 |
| A. | ①=②=③=④ | B. | ①=③>②=④ | C. | ④=②>③=① | D. | ①>③>②>④ |
①纯铁不容易生锈 ②钠着火用水扑灭 ③铝在空气中耐腐蚀,所以铝是不活泼金属 ④缺钙会引起骨质疏松,缺铁会引起贫血 ⑤青铜、不锈钢、硬铝都是合金 ⑥KSCN溶液可以检验Fe3+离子 ⑦Al和Fe都能与某些氧化物反应.
| A. | ①②⑤⑥ | B. | ②③④⑤ | C. | ①③④⑤⑦ | D. | ①④⑤⑥⑦ |
 电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点.如图是某同学用0.1mol/LKOH溶液分别滴定体积均为20mL、浓度均为0.1mol/L的HCl和CH3COOH溶液滴定曲线示意图(混合溶液体积变化忽略不计).下列有关判断不正确的是( )
电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点.如图是某同学用0.1mol/LKOH溶液分别滴定体积均为20mL、浓度均为0.1mol/L的HCl和CH3COOH溶液滴定曲线示意图(混合溶液体积变化忽略不计).下列有关判断不正确的是( )| A. | 曲线①代表0.1mol/LKOH溶液滴定CH3COOH溶液的滴定曲线,曲线②代表0.1mol/LKOH溶液滴定HCl溶液的滴定曲线 | |
| B. | 在相同温度下,C点水电离的c(H+)大于A点水电离的c(H+) | |
| C. | 在A点的溶液中有:c(CH3COO-)+c(OH-)-c(H+)=0.05 mol/L | |
| D. | 在B点的溶液中有:c(K+)>c(OH-)>c(CH3COO-)>c(H+) |
 ③F-,④
③F-,④ 其核外电子数相同的是( )
其核外电子数相同的是( )| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①③④ |
| A. | 实验室制取硝基苯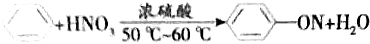 | |
| B. | 实验室制取溴苯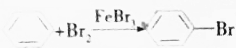 | |
| C. | 溴乙烷的消去反应 CH3CH2Br+NaOH$→_{△}^{H_{2}O}$CH2═CH2↑+NaBr+H2O | |
| D. | 制取TNT |