题目内容
1.化学与社会、生活、环境密切相关.下列有关说法不正确的是( )| A. | 酒精、汽油都是有机溶剂,可以清洗衣服上的油污斑点 | |
| B. | 硫酸可以作铅蓄电池的电解质,也可用于溶解除去锅炉和水壶里的水垢 | |
| C. | 废旧塑料制品、废旧金属制品要回收和利用 | |
| D. | 推广太阳能、风能等新能源技术是施行低碳经济的有效途径 |
分析 A.油污易溶于有机物;
B.反应生成的硫酸钙附着在碳酸钙的表面;
C.塑料制品、废旧金属制品可回收利用;
D.太阳能、风能是清洁能源.
解答 解:A.油污易溶于酒精、汽油等有机物,故A正确;
B.反应生成的硫酸钙附着在碳酸钙的表面,阻止反应进一步进行,故B错误;
C.塑料制品、废旧金属制品可回收利用,节能减排,故C正确;
D.太阳能、风能是清洁能源,可减少二氧化碳的排放,故D正确.
故选B.
点评 本题考查环境污染及治理,为高频考点,侧重于化学与生活、生产、能源与环境的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
11.上述反应在5min末时,已反应的Y值占原来量的物质的量分数( )
| A. | 20% | B. | 25% | C. | 33% | D. | 50% |
16.关于0.1mol•L-1 H2SO4溶液的叙述错误的是( )
| A. | 1 L该溶液中含有H2SO4的质量为9.8 g | |
| B. | 将0.1mol H2SO4溶于1L水中可得该溶液 | |
| C. | 0.5 L该溶液中氢离子的物质的量浓度为0.2 mol•L-1 | |
| D. | 从1 L该溶液中取出100 mL,则取出溶液中H2SO4的物质的量浓度为0.1 mol•L-1 |
6.有关图所示装置的叙述中正确的是( )
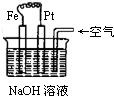

| A. | 这是电解NaOH溶液的装置 | |
| B. | 这是一个原电池装置,利用该装置可长时间观察Fe(OH)2沉淀的颜色 | |
| C. | Pt为正极,其电极反应为:O2+2H2O+4e-═4OH- | |
| D. | Fe为阳极,其电极反应为:Fe+2OH-2e-═Fe(OH)3 |
13.关于下列图示的说法中正确的是( )
| A. |  如图装置用于分离沸点相关较大的互溶液体混合物 | |
| B. | 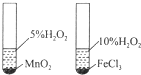 如图装置用于研究不同催化剂对反应速率的影响 | |
| C. | 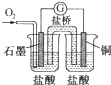 图中电流计的指针发生偏转,石墨为正极 | |
| D. |  如图装置可用于检验溴乙烷与NaOH的醇溶液共热产生的乙烯 |
10.下列图象能正确反映对应变化关系的是( )
| A | B | C | D |
| 一定温度下,向不饱和硝酸钾溶液中加入硝酸钾 | 向一定量NaOH溶液中加入稀H2SO4 | 向一定量铁粉和铜粉的混合物中加入硫酸铜溶液 | 向相等质量的锌粉和铁粉中,分别加入质量分数相同的稀盐酸 |
 |  |  | 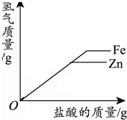 |
| A. | A | B. | B | C. | C | D. | D |
11.草酸合铁酸钾晶体Kx[Fe(C2O4)y]•3H2O是一种光敏材料,见光易分解,下面是一种制备草酸合铁酸钾晶体的实验流程.

已知:(NH4)2SO4、FeSO4•7H2O、莫尔盐[(NH4)2SO4•FeSO4•6H2O]的溶解度如表:
(1)废铁屑在进行“溶解1”前,需用在5% Na2CO3溶液中加热数分钟,并洗涤干净.Na2CO3溶液的作用是除油污.
(2)“溶解1”应保证铁屑稍过量,其目的是防止Fe2+被氧化为Fe3+.“溶解2”加“几滴H2SO4”的作用是防止Fe2+水解.
(3)“复分解”制备莫尔盐晶体的基本实验步骤是:蒸发浓缩、冷却结晶、过滤、用乙醇洗涤、干燥.用乙醇洗涤的目的是冷却结晶,洗去杂质,减少莫尔盐晶体溶解损失,便于快速干燥.
(4)“沉淀2”时得到的FeC2O4•2H2O沉淀需用水洗涤干净.检验沉淀是否洗涤干净的方法是
用小试管取少量最后一次洗涤液,加入BaCl2溶液,如出现白色沉淀,说明沉淀没有洗涤干净,否则,沉淀已洗涤干净
(5)“结晶”时应将溶液放在黑暗处等待晶体的析出,这样操作的原因是黑暗可以防止晶体分解.
(6)请补全测定草酸合铁酸钾产品中Fe3+含量的实验步骤
【备选试剂:KMnO4溶液、锌粉、铁粉、NaOH溶液】:
步骤1:准确称取所制备的草酸合铁酸钾晶体a g,配成250mL待测液.
步骤2:用移液管移取25.00mL待测液于锥形瓶中,加入稀H2SO4酸化,加入足量KMnO4溶液,使C2O42-转化为CO2被除去.
步骤3:向步骤2所得溶液中加入稍过量的锌粉,加热至充分反应(溶液黄色刚好消失),过滤、洗涤、将过滤及洗涤所得溶液收集到锥形瓶中
步骤4:用c mol•L-1 KMnO4标准溶液滴定步骤3所得溶液至终点,消耗V mL KMnO4标准溶液.

已知:(NH4)2SO4、FeSO4•7H2O、莫尔盐[(NH4)2SO4•FeSO4•6H2O]的溶解度如表:
| 温度/℃ | 10 | 20 | 30 | 40 | 50 |
| (NH4)2SO4/g | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 |
| FeSO4•7H2O/g | 40.0 | 48.0 | 60.0 | 73.3 | - |
| (NH4)2SO4•FeSO4•6H2O/g | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 |
(2)“溶解1”应保证铁屑稍过量,其目的是防止Fe2+被氧化为Fe3+.“溶解2”加“几滴H2SO4”的作用是防止Fe2+水解.
(3)“复分解”制备莫尔盐晶体的基本实验步骤是:蒸发浓缩、冷却结晶、过滤、用乙醇洗涤、干燥.用乙醇洗涤的目的是冷却结晶,洗去杂质,减少莫尔盐晶体溶解损失,便于快速干燥.
(4)“沉淀2”时得到的FeC2O4•2H2O沉淀需用水洗涤干净.检验沉淀是否洗涤干净的方法是
用小试管取少量最后一次洗涤液,加入BaCl2溶液,如出现白色沉淀,说明沉淀没有洗涤干净,否则,沉淀已洗涤干净
(5)“结晶”时应将溶液放在黑暗处等待晶体的析出,这样操作的原因是黑暗可以防止晶体分解.
(6)请补全测定草酸合铁酸钾产品中Fe3+含量的实验步骤
【备选试剂:KMnO4溶液、锌粉、铁粉、NaOH溶液】:
步骤1:准确称取所制备的草酸合铁酸钾晶体a g,配成250mL待测液.
步骤2:用移液管移取25.00mL待测液于锥形瓶中,加入稀H2SO4酸化,加入足量KMnO4溶液,使C2O42-转化为CO2被除去.
步骤3:向步骤2所得溶液中加入稍过量的锌粉,加热至充分反应(溶液黄色刚好消失),过滤、洗涤、将过滤及洗涤所得溶液收集到锥形瓶中
步骤4:用c mol•L-1 KMnO4标准溶液滴定步骤3所得溶液至终点,消耗V mL KMnO4标准溶液.
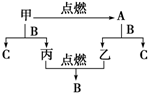 A、B、C是三种常见的化合物,A为淡黄色固体.它们之间的转化关系如图所示.完成下列空白:
A、B、C是三种常见的化合物,A为淡黄色固体.它们之间的转化关系如图所示.完成下列空白:

 .
. .
. .
.