题目内容
11.上述反应在5min末时,已反应的Y值占原来量的物质的量分数( )| A. | 20% | B. | 25% | C. | 33% | D. | 50% |
分析 把0.6molX气体和0.4molY气体混合于2L容器中,5min末已生成0.2molW,则:
3X(气)+Y(气)═nZ(气)+2W(气)
起始量(mol):0.6 0.4 0 0
变化量(mol):0.3 0.1 0.1n 0.2
5min末(mol)0.3 0.3 0.1n 0.2
根据已反应的Y的物质的量占原来量的百分数=$\frac{消耗的Y的物质的量}{Y的起始物质的量}$×100%计算.
解答 解:把0.6molX气体和0.4molY气体混合于2L容器中,5min末已生成0.2molW,则:
3X(气)+Y(气)═nZ(气)+2W(气)
起始量(mol):0.6 0.4 0 0
变化量(mol):0.3 0.1 0.1n 0.2
5min末(mol)0.3 0.3 0.1n 0.2
所以已反应的Y的物质的量占原来量的百分数=$\frac{消耗的Y的物质的量}{Y的起始物质的量}$×100%=$\frac{0.1mol}{0.4mol}$×100%=25%,
故选B.
点评 本题考查化学平衡计算、反应速率计算,比较基础,注意对速率定义式的理解与灵活应用.

练习册系列答案
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案 培优三好生系列答案
培优三好生系列答案
相关题目
6.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度T的关系如表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)×c({H}_{2}O)}{c(C{O}_{2})×c({H}_{2})}$
(2)该反应为吸热反应(填“吸热”或“放热”).
(3)某温度下,各物质的平衡浓度符合下式:3c(CO2)•c(H2)=5c(CO)•c(H2O),试判断此时的温度 为700℃
(4)若830℃时,向容器中充入1mol CO、5mol H2O,反应达到平衡后,其化学平衡常数 K等于1.0(填“大于”“小于”或“等于”).
(5)830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,扩大容器的体积,平衡不移动(填“向正反应方向”“向逆反应方向”或“不”).
(6)若1200℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2mol/L、2mol/L、4mol/L、4mol/L,则此时上述反应的平衡移动方向为逆反应方向(填“正反应方向”“逆反应方向”或“不移动”)
| T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)×c({H}_{2}O)}{c(C{O}_{2})×c({H}_{2})}$
(2)该反应为吸热反应(填“吸热”或“放热”).
(3)某温度下,各物质的平衡浓度符合下式:3c(CO2)•c(H2)=5c(CO)•c(H2O),试判断此时的温度 为700℃
(4)若830℃时,向容器中充入1mol CO、5mol H2O,反应达到平衡后,其化学平衡常数 K等于1.0(填“大于”“小于”或“等于”).
(5)830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,扩大容器的体积,平衡不移动(填“向正反应方向”“向逆反应方向”或“不”).
(6)若1200℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2mol/L、2mol/L、4mol/L、4mol/L,则此时上述反应的平衡移动方向为逆反应方向(填“正反应方向”“逆反应方向”或“不移动”)
3.下列说法正确的是( )
| A. | 常温下,反应C(s)+H2O(g)═CO(g)+H2(g)不能自发进行,则该反应的△H>0 | |
| B. | 一定温度下,反应MgCl2(l)═Mg(l)+Cl2(g)的△H>0,△S<0 | |
| C. | 放热的自发过程,一定是熵增加的过程 | |
| D. | 液态水可自发挥发成水蒸气的过程是熵减的过程 |
1.化学与社会、生活、环境密切相关.下列有关说法不正确的是( )
| A. | 酒精、汽油都是有机溶剂,可以清洗衣服上的油污斑点 | |
| B. | 硫酸可以作铅蓄电池的电解质,也可用于溶解除去锅炉和水壶里的水垢 | |
| C. | 废旧塑料制品、废旧金属制品要回收和利用 | |
| D. | 推广太阳能、风能等新能源技术是施行低碳经济的有效途径 |
 t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g)?2SO3(g),120s时反应达到化学平衡,此时测得反应物O2还剩余0.2mol,请填写下列空白:
t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g)?2SO3(g),120s时反应达到化学平衡,此时测得反应物O2还剩余0.2mol,请填写下列空白:
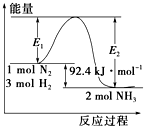 合成氨工业的核心反应是N2(g)+3H2(g)?2NH3(g);反应过程中能量变化如图所示,回答下列问题.
合成氨工业的核心反应是N2(g)+3H2(g)?2NH3(g);反应过程中能量变化如图所示,回答下列问题.