题目内容
 某研究性小组用0.20mol/L NaOH溶液滴定未知浓度的白醋(指示剂为酚酞).
某研究性小组用0.20mol/L NaOH溶液滴定未知浓度的白醋(指示剂为酚酞).请回答:
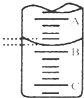
(1)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为20,此时滴定管中液体的体积
(2)滴定过程中,眼睛始终注视滴定管滴速和
(3)同学们进行了三次实验,每次取白醋20.00mL,实验结果记录如表:
| 滴定 | 标准NaOH溶液体积/mL | |
| 次数 | 滴定前读数/mL | 滴定后读数/mL |
| 第一次 | 0.02 | 25.00 |
| 第二次 | 0.01 | 25.03 |
| 第三次 | 0.03 | 26.35 |
(4)操作时用白醋润洗锥形瓶,对滴定结果产生的影响是
(5)若滴定终点时测得pH=7.下列离子浓度的比较正确的是
A.c(Na+)>c(CH3COO-) B.c(Na+)<c(CH3COO-)
C.c(Na+)=c(CH3COO-) D.不能确定.
考点:中和滴定
专题:实验题
分析:(1)A与C刻度间相差1ml,说明每两个小格之间是0.1mL,A处的刻度 20,据此确定B的刻度,注意滴定管的上面数值小,下面数值大;
(2)滴定时,眼睛始终注视滴定管滴速和锥形瓶中溶液颜色的变化;滴定终点时溶液颜色由无色变为浅红色,且半分钟内不褪色;
(3)先根据数据的有效性,然后求出平均消耗V(NaOH),接着根据c(待测)=
来计算;
(4)根据c(待测)=
分析误差;
(5)在滴定过程中,溶液中离子电荷守恒.
(2)滴定时,眼睛始终注视滴定管滴速和锥形瓶中溶液颜色的变化;滴定终点时溶液颜色由无色变为浅红色,且半分钟内不褪色;
(3)先根据数据的有效性,然后求出平均消耗V(NaOH),接着根据c(待测)=
| V(标准)×c(标准) |
| V(待测) |
(4)根据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
(5)在滴定过程中,溶液中离子电荷守恒.
解答:
解:(1)A与C刻度间相差1ml,说明每两个小格之间是0.10mL,A处的刻度为20,A和B之间是5个小格,所以相差0.50mL,则液面读数为20.40mL,由于滴定管50.00mL刻度下方还有液体,所以实际溶液的液体大于29.60mL,
故答案为:大于29.60;
(2)滴定过程中,眼睛始终注视滴定管滴速和锥形瓶中溶液颜色的变化;根据滴定终点,溶液由无色恰好变为红色,且半分钟内不褪色,停止滴定;
故答案为:锥形瓶中溶液颜色的变化;滴入最后一滴,溶液由无色恰好变为红色,且半分钟内不褪色;
(3)三次滴定消耗的体积为:24.98mL,25.02mL,26.32mL,第三组数据无效,则平均消耗V(NaOH)=25.00mL,c(待测)=
=
=0.25 mol/L;
故答案为:0.25 mol/L;
(4)操作时用白醋润洗锥形瓶,待测液的物质的量偏大,造成V(标准)偏大,根据c(待测)=
分析,可知c(待测)偏大;
故答案为:偏大;
(5)在滴定过程中,溶液中离子电荷守恒,关系式为c(CH3COO-)+c(OH-)=c(Na+)+c(H+),若滴定终点时测得pH=7,即c(OH-)=c(H+),所以c(CH3COO-)=c(Na+),故选C.
故答案为:大于29.60;
(2)滴定过程中,眼睛始终注视滴定管滴速和锥形瓶中溶液颜色的变化;根据滴定终点,溶液由无色恰好变为红色,且半分钟内不褪色,停止滴定;
故答案为:锥形瓶中溶液颜色的变化;滴入最后一滴,溶液由无色恰好变为红色,且半分钟内不褪色;
(3)三次滴定消耗的体积为:24.98mL,25.02mL,26.32mL,第三组数据无效,则平均消耗V(NaOH)=25.00mL,c(待测)=
| V(标准)×c(标准) |
| V(待测) |
| 0.20mol/L×25.00mL |
| 20.00ml |
故答案为:0.25 mol/L;
(4)操作时用白醋润洗锥形瓶,待测液的物质的量偏大,造成V(标准)偏大,根据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
故答案为:偏大;
(5)在滴定过程中,溶液中离子电荷守恒,关系式为c(CH3COO-)+c(OH-)=c(Na+)+c(H+),若滴定终点时测得pH=7,即c(OH-)=c(H+),所以c(CH3COO-)=c(Na+),故选C.
点评:本题主要考查了滴定操作,误差分析以及化学计算,难度不大,在进行误差分析时根据c(待测)=
分析.
| c(标准)×V(标准) |
| V(待测) |

练习册系列答案
相关题目
向20.00mL稀H2SO4中逐滴加入0.10mol/L的氨水,测得溶液的pH随加入氨水的体积变化如图所示.下列判断正确的是( )
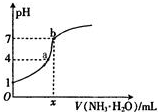

| A、x=20 |
| B、稀H2SO4的浓度为0.10mol/L |
| C、a点可能是:c(H+)>c(SO42-)>c(NH4+)>c(OH-) |
| D、b点表示稀H2SO4和氨水恰好中和 |
鉴别纯碱,石灰石,芒硝、石膏四种白色固体物质,下列试剂中应该选用( )
| A、NaOH溶液 |
| B、HNO3溶液 |
| C、水和盐酸 |
| D、BaCl2和HNO3溶液 |
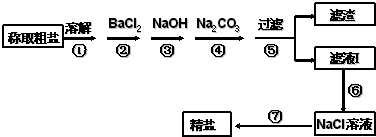 四川省自贡盛产食盐,人类与食盐关系密切,食盐在老百姓生活和现代社会的工农业生产中均有重要作用,没有食盐的生活是不可以想象的,为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如图(用于沉淀的试剂稍过量):
四川省自贡盛产食盐,人类与食盐关系密切,食盐在老百姓生活和现代社会的工农业生产中均有重要作用,没有食盐的生活是不可以想象的,为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如图(用于沉淀的试剂稍过量):