题目内容
某强氧化剂RO3-中R元素能被还原成较低的价态,如果还原2.4×10-2molRO3-需要6×10-2molNa2SO3(Na2SO3转化成Na2SO4),则反应后R元素的价态是( )
| A、0 | B、+1 | C、+3 | D、+4 |
考点:氧化还原反应的计算
专题:氧化还原反应专题
分析:RO3-离子中R的化合价为+5价,将Na2SO3氧化生成Na2SO4,令R元素在还原产物中化合价为a,结合氧化还原反应中氧化剂和还原剂得失电子数目计算.
解答:
解:n(Na2SO3)=6×10-2mol,被氧化后生成Na2SO4,
RO3-离子中R的化合价为+5价,设还原后的化合价为a,
根据电子转移守恒:6×10-2mol×(6-4)=2.4×10-2mol×(5-a),
解得a=0,
故选A.
RO3-离子中R的化合价为+5价,设还原后的化合价为a,
根据电子转移守恒:6×10-2mol×(6-4)=2.4×10-2mol×(5-a),
解得a=0,
故选A.
点评:本题考查氧化还原反应的计算,为高考常见题型,侧重于学生的分析能力和计算能力的考查,注意从电子转移守恒角度解答,难度不大.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
下列有关问题,与盐类的水解无关的是( )
| A、NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂 |
| B、盐酸可作铁制品的除锈剂 |
| C、实验室盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞 |
| D、加热蒸干AlCl3溶液得到Al(OH)3固体 |
下列溶液中,由水电离出的c(H+)<10-7mol?L-1的是( )
| A、25℃时,0.01mol?L-1NH4Cl溶液 |
| B、25℃时,0.01mol?L-1NaHSO4溶液 |
| C、100℃时,0.01mol?L-1NaNO3溶液 |
| D、25℃时,0.01mol?L-1NaF溶液 |
下列电离方程式中,正确的是( )
| A、Al2(SO4)3═2Al3++3SO42- |
| B、NaHCO3═Na++H++CO32- |
| C、CH3COOH═CH3COO-+H+ |
| D、Na2CO3═Na2++CO32- |
四个试管中都装有5mL 0.1mol?L-1 Na2S2O3溶液,分别在不同温度下加入硫酸和一定量水,最先出现浑浊的是( )
| A、20℃,10 mL 0.1mol?L-1硫酸 |
| B、20℃,5 mL 0.1 mol?L-1硫酸和5 mL水 |
| C、30℃,10 mL 1 mol?L-1硫酸 |
| D、30℃,5 mL 1 mol?L-1硫酸和5 mL水 |
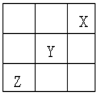 (1)根据氢元素最高正价最低负价的绝对值相等,有人提议把氢元素放在周期表中的ⅣA族.那么根据NaH的存在,又可把氢元素放在
(1)根据氢元素最高正价最低负价的绝对值相等,有人提议把氢元素放在周期表中的ⅣA族.那么根据NaH的存在,又可把氢元素放在 某研究性小组用0.20mol/L NaOH溶液滴定未知浓度的白醋(指示剂为酚酞).
某研究性小组用0.20mol/L NaOH溶液滴定未知浓度的白醋(指示剂为酚酞).