题目内容
已知固体E常用于食品烘焙工业,俗称小苏打,单质C遇浓硫酸钝化,难反应.单质D为气体,气体C为无色无味气体.根据下列框图填写下列空格:
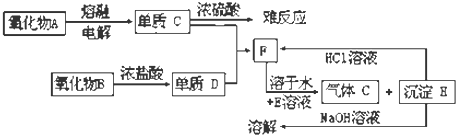
(1)单质C是 ,D是 ,气体C是 ,E是 ,H是 .
(2)写出下列反应的化学方程式:
氧化物B+浓盐酸加热反应: .电解熔融的氧化物A: .H与NaOH溶液反应: .

(1)单质C是
(2)写出下列反应的化学方程式:
氧化物B+浓盐酸加热反应:
考点:无机物的推断
专题:推断题
分析:固体E俗称小苏打,E为NaHCO3;单质C遇浓硫酸钝化,且单质C和沉淀H均能生成F,而沉淀H能与氢氧化钠溶液反应,可推断单质C为Al;氧化物B与浓盐酸反应生成单质D,能与Al反应,推断B为二氧化锰,D为Cl2,F为氯化铝,沉淀H为氢氧化铝;氯化铝与碳酸氢钠反应生成二氧化碳气体,气体C为二氧化碳,依此解答.
解答:
解:固体E俗称小苏打,E为NaHCO3;单质C遇浓硫酸钝化,且单质C和沉淀H均能生成F,而沉淀H能与氢氧化钠溶液反应,可推断单质C为Al;氧化物B与浓盐酸反应生成单质D,能与Al反应,推断B为二氧化锰,D为Cl2,F为氯化铝,沉淀H为氢氧化铝;氯化铝与碳酸氢钠反应生成二氧化碳气体,气体C为二氧化碳,
(1)由上分析,单质C是 Al,D是 Cl2,气体C是 CO2,E是 NaHCO3,H是 Al(OH)3,故答案为:Al;Cl2;CO2;NaHCO3;Al(OH)3;
(2)MnO2与浓盐酸反应生成氯气,反应方程式为MnO2+4HCl=MnCl2+Cl2+2H2O,电解熔融的氧化铝方程式为2Al2O3(熔融)
4Al+3O2,氢氧化铝与氢氧化钠反应方程式为Al(OH)3+NaOH=NaAlO2+2H2O,
故答案为:MnO2+4HCl=MnCl2+Cl2+2H2O;2Al2O3(熔融)
4Al+3O2;Al(OH)3+NaOH=NaAlO2+2H2O.
(1)由上分析,单质C是 Al,D是 Cl2,气体C是 CO2,E是 NaHCO3,H是 Al(OH)3,故答案为:Al;Cl2;CO2;NaHCO3;Al(OH)3;
(2)MnO2与浓盐酸反应生成氯气,反应方程式为MnO2+4HCl=MnCl2+Cl2+2H2O,电解熔融的氧化铝方程式为2Al2O3(熔融)
| ||
故答案为:MnO2+4HCl=MnCl2+Cl2+2H2O;2Al2O3(熔融)
| ||
点评:本题考查了无机物的推断,明确物质的性质及特殊性质是解本题关键,同时考查学生知识综合运用能力,难度中等.

练习册系列答案
相关题目
下列电离方程式中,正确的是( )
| A、Al2(SO4)3═2Al3++3SO42- |
| B、NaHCO3═Na++H++CO32- |
| C、CH3COOH═CH3COO-+H+ |
| D、Na2CO3═Na2++CO32- |
四个试管中都装有5mL 0.1mol?L-1 Na2S2O3溶液,分别在不同温度下加入硫酸和一定量水,最先出现浑浊的是( )
| A、20℃,10 mL 0.1mol?L-1硫酸 |
| B、20℃,5 mL 0.1 mol?L-1硫酸和5 mL水 |
| C、30℃,10 mL 1 mol?L-1硫酸 |
| D、30℃,5 mL 1 mol?L-1硫酸和5 mL水 |


 某研究性小组用0.20mol/L NaOH溶液滴定未知浓度的白醋(指示剂为酚酞).
某研究性小组用0.20mol/L NaOH溶液滴定未知浓度的白醋(指示剂为酚酞).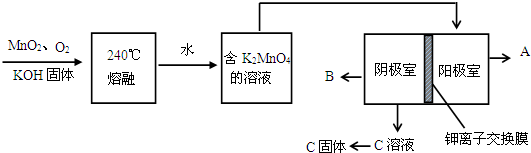
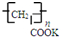 ),聚丙烯酸钾单体的结构简式为
),聚丙烯酸钾单体的结构简式为
