题目内容
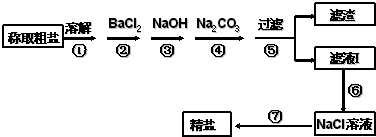 四川省自贡盛产食盐,人类与食盐关系密切,食盐在老百姓生活和现代社会的工农业生产中均有重要作用,没有食盐的生活是不可以想象的,为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如图(用于沉淀的试剂稍过量):
四川省自贡盛产食盐,人类与食盐关系密切,食盐在老百姓生活和现代社会的工农业生产中均有重要作用,没有食盐的生活是不可以想象的,为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如图(用于沉淀的试剂稍过量):请回答:
(1)步骤⑦需采用的主要物质分离提纯操作,名称是
(2)步骤③加入过量NaOH的目的是:
(3)步骤⑥需加入适量的
(4)步骤④主要发生两个化学反应,其离子方程式为:
(5)含碘食盐往往加入KIO3,为了检验实验中是否含KIO3,可以用以下反应进行:KIO3+5KI+3H2SO4=═3I2+3K2SO4+3H2O,写出该反应的离子方程式
考点:物质分离、提纯的实验方案设计
专题:实验设计题
分析:由流程可知,溶解后,②中加氯化钡可除去硫酸根离子,③中加NaOH除去镁离子,④中加碳酸钠可除去钡离子、钙离子,过滤后滤液主要为氯化钠和碳酸钠,⑥中加盐酸反应后溶液中溶质为NaCl,然后蒸发结晶得到NaCl,以此来解答.
解答:
解:由流程可知,溶解后,②中加氯化钡可除去硫酸根离子,③中加NaOH除去镁离子,④中加碳酸钠可除去钡离子、钙离子,过滤后滤液主要为氯化钠和碳酸钠,⑥中加盐酸反应后溶液中溶质为NaCl,然后蒸发结晶得到NaCl,
(1)由上述分析可知,步骤⑦为蒸发,需要的仪器除铁架台、酒精灯、玻璃棒外,还要蒸发皿,故答案为:蒸发;蒸发皿;
(2)步骤③加入过量NaOH的目的是使Mg2+完全沉淀,故答案为:使Mg2+完全沉淀;
(3)步骤⑥需加入适量的盐酸,发生的离子反应为H++OH-=H2O、2H++CO32-=H2O+CO2↑,故答案为:盐酸;H++OH-=H2O;2H++CO32-=H2O+CO2↑;
(4)步骤④加碳酸钠,主要发生两个离子方程式为Ca2++CO32-=CaCO3↓、Ba2++CO32-=BaCO3↓,故答案为:Ca2++CO32-=CaCO3↓;Ba2++CO32-=BaCO3↓;
(5)KIO3+5KI+3H2SO4=═3I2+3K2SO4+3H2O中,I2、H2O在离子反应中保留化学式,则离子反应为IO3-+5I-+6H+=3I2+3H2O,故答案为:IO3-+5I-+6H+=3I2+3H2O.
(1)由上述分析可知,步骤⑦为蒸发,需要的仪器除铁架台、酒精灯、玻璃棒外,还要蒸发皿,故答案为:蒸发;蒸发皿;
(2)步骤③加入过量NaOH的目的是使Mg2+完全沉淀,故答案为:使Mg2+完全沉淀;
(3)步骤⑥需加入适量的盐酸,发生的离子反应为H++OH-=H2O、2H++CO32-=H2O+CO2↑,故答案为:盐酸;H++OH-=H2O;2H++CO32-=H2O+CO2↑;
(4)步骤④加碳酸钠,主要发生两个离子方程式为Ca2++CO32-=CaCO3↓、Ba2++CO32-=BaCO3↓,故答案为:Ca2++CO32-=CaCO3↓;Ba2++CO32-=BaCO3↓;
(5)KIO3+5KI+3H2SO4=═3I2+3K2SO4+3H2O中,I2、H2O在离子反应中保留化学式,则离子反应为IO3-+5I-+6H+=3I2+3H2O,故答案为:IO3-+5I-+6H+=3I2+3H2O.
点评:本题考查物质分离、提纯实验方案的设计,为高频考点,把握粗盐提纯流程中的分离方法及发生的离子反应为解答的关键,侧重分析能力及物质除杂的考查,题目难度不大.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
氯仿(CHCl3,非电解质)在空气中能发生缓慢氧化,生成剧毒物质光气(COCl2,非电解质),化学方程式为:2CHCl3+O2═2COCl2+2HCl.检验氯仿是否被氧化应选择的试剂是( )
| A、淀粉-KI溶液 |
| B、NaOH溶液 |
| C、酚酞溶液 |
| D、硝酸酸化的硝酸银溶液 |
下列叙述中正确的是( )
(1)纯铁比碳素钢易生锈
(2)用氨水除去试管上的银镜
(3)硅是制作光导纤维和制造太阳能电池的主要原料
(4)可用稀盐酸、碳酸钠溶液、硅酸钠溶液设计实验来验证元素的非金属性Cl>C(碳)>Si
(5)催化剂只能改变反应的活化能,不能改变反应的热效应
(6)用氢氟酸雕刻玻璃是利用氢氟酸能与二氧化硅反应的性质
(7)同主族元素的简单阴离子还原性越强,水解程度越大
(8)Al2O3在工业上用于制作耐高温材料,也用于电解法治炼铝
(9)丁达尔效应可用于区别溶液与胶体,云、雾均能产生丁达尔效应
(10)明矾可用于水的消毒、杀菌;碳酸钡可用于钡餐透视.
(1)纯铁比碳素钢易生锈
(2)用氨水除去试管上的银镜
(3)硅是制作光导纤维和制造太阳能电池的主要原料
(4)可用稀盐酸、碳酸钠溶液、硅酸钠溶液设计实验来验证元素的非金属性Cl>C(碳)>Si
(5)催化剂只能改变反应的活化能,不能改变反应的热效应
(6)用氢氟酸雕刻玻璃是利用氢氟酸能与二氧化硅反应的性质
(7)同主族元素的简单阴离子还原性越强,水解程度越大
(8)Al2O3在工业上用于制作耐高温材料,也用于电解法治炼铝
(9)丁达尔效应可用于区别溶液与胶体,云、雾均能产生丁达尔效应
(10)明矾可用于水的消毒、杀菌;碳酸钡可用于钡餐透视.
| A、(1)(4)(6)(7) |
| B、(4)(6)(9)(10) |
| C、(3)(5)(6)(8) |
| D、(5)(6)(8)(9) |
下列不属于四种基本反应类型,但属于氧化还原反应的是( )
| A、Fe+H2SO4=FeSO4+H2↑ |
| B、CO+CuO═Cu+CO2↑ |
| C、Cu2(OH)2CO3═2CuO+H2O+CO2↑ |
| D、4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
 某研究性小组用0.20mol/L NaOH溶液滴定未知浓度的白醋(指示剂为酚酞).
某研究性小组用0.20mol/L NaOH溶液滴定未知浓度的白醋(指示剂为酚酞).
