题目内容
将NO2装入带活塞的密闭容器中,当反应2NO2(g)?N2O4(g)达到平衡后,改变下列一个条件,其中叙述正确的是( )
| A、升高温度,气体颜色加深,则此反应为吸热反应 |
| B、慢慢压缩气体体积,平衡向右移动,混合气体颜色变浅 |
| C、慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍 |
| D、恒温恒容时,充入少量惰性气体,压强增大,平衡向右移动,混合气体的颜色变浅 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:A.升高温度,平衡向吸热反应方向移动;
B.缩小条件,相当于增大压强,平衡向气体体积减小的方向移动;
C.慢慢压缩气体体积,若体积减小一半,压强增大,平衡向气体体积减小的方向移动;
D.恒温恒容时,充入少量惰性气体,压强增大,但反应物浓度不变,所以平衡不移动.
B.缩小条件,相当于增大压强,平衡向气体体积减小的方向移动;
C.慢慢压缩气体体积,若体积减小一半,压强增大,平衡向气体体积减小的方向移动;
D.恒温恒容时,充入少量惰性气体,压强增大,但反应物浓度不变,所以平衡不移动.
解答:
解:A.升高温度,平衡向吸热反应方向移动,如果气体颜色加深,则平衡向逆反应方向移动,所以此反应为放热反应,故A错误;
B.缩小条件,相当于增大压强,平衡向气体体积减小的方向正反应方向移动,但平衡时混合气体颜色比原来深,故B错误;
C.慢慢压缩气体体积,若体积减小一半,压强增大,平衡向气体体积减小的方向正反应方向移动,因为存在化学平衡,所以虽然压强增大,但小于原来的两倍,故C正确;
D.恒温恒容时,充入少量惰性气体,压强增大,但反应物浓度不变,所以平衡不移动,混合气体颜色不变,故D错误;
故选C.
B.缩小条件,相当于增大压强,平衡向气体体积减小的方向正反应方向移动,但平衡时混合气体颜色比原来深,故B错误;
C.慢慢压缩气体体积,若体积减小一半,压强增大,平衡向气体体积减小的方向正反应方向移动,因为存在化学平衡,所以虽然压强增大,但小于原来的两倍,故C正确;
D.恒温恒容时,充入少量惰性气体,压强增大,但反应物浓度不变,所以平衡不移动,混合气体颜色不变,故D错误;
故选C.
点评:本题考查了外界条件对化学平衡的影响,根据反应特点及外界条件对化学平衡的影响来分析解答,易错选项是BD,B中体积减小,虽然平衡向正反应方向移动,但平衡时气体颜色要比原来平衡时深,D中虽然总压强增大,但反应物的压强不变,所以平衡不移动,为易错点.

练习册系列答案
相关题目
下列反应的离子方程式正确的是( )
A、向沸水中滴加饱和FeCl3溶液制备Fe(OH)3 胶体:Fe3++3H2O
| ||||
B、用小苏打治疗胃酸过多:HCO
| ||||
C、实验室用浓盐酸与MnO2制Cl2:MnO2+2H++2Cl-
| ||||
| D、将金属钠投入水中:Na+H2O=Na++OH-+H2↑ |
对于常温下0.1mol?L-1氨水和0.1mol?L-1醋酸,下列说法正确的是( )
| A、0.1mol?L-1氨水,溶液的pH=13 |
| B、0.1mol?L-1氨水加水稀释,溶液中c(H+)和c(OH-)都减小 |
| C、0.1mol?L-1醋酸溶液中:c(H+)=c(CH3COO-) |
| D、0.1mol?L-1醋酸与0.1mol?L-1 NaOH溶液等体积混合所得溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
 美国圣路易斯大学研制新型的乙醇燃料电池,用质子(H+)溶剂,在200℃左右供电.电池总反应为:C2H5OH+3O2→2CO2+3H2O,如图是该电池的示意图,下列说法正确的是( )
美国圣路易斯大学研制新型的乙醇燃料电池,用质子(H+)溶剂,在200℃左右供电.电池总反应为:C2H5OH+3O2→2CO2+3H2O,如图是该电池的示意图,下列说法正确的是( )| A、a极为电池的正极 |
| B、电池工作时电流由a极沿导线经灯泡再到b极 |
| C、电池正极的电极反应为:4H++O2+4e-═2H2O |
| D、电池工作时,1mol乙醇被氧化时就有6mol电子转移 |
 如图,其电池反应为:2CH3OH+3O2+4OH-=2CO32-+6H2O,则下列说法正确的是( )
如图,其电池反应为:2CH3OH+3O2+4OH-=2CO32-+6H2O,则下列说法正确的是( )| A、充电时有CH3OH生成的电极为阳极 |
| B、放电时电解质溶液的pH逐渐增大 |
| C、放电时负极的电极反应为:CH3OH-6e-+8OH-=CO32-+6H2O |
| D、充电时每生成1 mol CH3OH转移12mol电子 |
下列各组物质中,互为同分异构体的是( )
| A、冰和水 |
| B、氧气和臭氧 |
| C、1H与3H |
| D、CH3CH20H和CH30CH3 |
X、Y、Z、W是前20号元素,原子序数依次增大.X是原子半径最小的元素;Y元素原子的最外层电子数是电子层数的2倍;Z元素的-1价阴离子的核外电子排布与氖原子相同,W元素为金属,它的某种化合物可用于烟气脱硫.下列说法错误的是( )
| A、X、Y形成的化合物中可能含有双键 |
| B、X单质和Z单质在暗处能剧烈反应 |
C、W元素与Z元素形成的化合物用电子式表示形成过程为: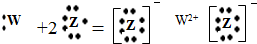 |
| D、XZ的沸点在与Z同族的其它X的化合物中最高 |