题目内容
3.据报道,氢燃料电池公交汽车已经驶上北京街头.下列说法正确的( )| A. | 氢燃料电池汽车的使用可以有效减少城市空气污染 | |
| B. | 电解水制取氢气是理想而经济的制氢方法 | |
| C. | 发展氢燃料电池汽车不需要安全高效的储氢技术 | |
| D. | 氢燃料电池把氢气和氧气燃烧放出的热能转化为电能 |
分析 A、氢氧燃料电池的产物是水;
B、电解水制取氢气消耗大量的电能;
C、氢气密度小,安全高效的储氢技术是难题;
D、原电池是将化学能转化为电能的装置.
解答 解:A、氢氧燃料电池的生成产物是水,环保无污染,所以氢燃料电池汽车的使用可以有效减少城市空气污染,故A正确;
B、电解水制取氢气消耗大量的电能,电解水制取氢气是理想而经济的制氢方法,故B错误;
C、氢气密度小,发展氢燃料电池汽车,安全高效的储氢技术是难题,故C错误;
D、氢燃料电池属于原电池,是将化学能转化为电能的装置,故D错误.
故选A.
点评 本题考查燃料电池的能量转化以及工作原理,是化学和实际结合的知识考查,难度不大.

练习册系列答案
相关题目
12.用下列步骤制取物质,可以达到目的是( )
| A. | Al$\stackrel{氧气,加热}{→}$Al2O3$\stackrel{硝酸}{→}$Al(NO3)3$\stackrel{加热蒸干}{→}$硝酸铝晶体 | |
| B. | Cu$\stackrel{氧气,加热}{→}$CuO$\stackrel{稀硫酸}{→}$CuSO4$\stackrel{蒸干结晶}{→}$胆矾 | |
| C. | Fe$\stackrel{氯气}{→}$FeCl3$\stackrel{过量氨水}{→}$Fe(OH)3$\stackrel{加热}{→}$Fe2O3 | |
| D. | FeSO4溶液$\stackrel{硫化氢、过滤}{→}$FeS |
14.已知丁基有4种结构,分子式为C5H10O2的羧酸有( )
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
15.下列叙述正确的是( )
①热稳定性:H2O>HF>H2S
②泥水、淀粉溶液、盐酸分别属于悬浊液、胶体、溶液
③ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤第IA族元素铯的两种同位素137Cs比133Cs多4个质子
⑥已知2H2(g)+O2(g)=2H2O(l)△H=-571kJ•mol-1则氢气的燃烧热为△H=-285.5kJ•mol-1
⑦因为常温下白磷可自燃,而氮气须在放电时才与氧气反应,所以非金属性:P>N.
①热稳定性:H2O>HF>H2S
②泥水、淀粉溶液、盐酸分别属于悬浊液、胶体、溶液
③ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤第IA族元素铯的两种同位素137Cs比133Cs多4个质子
⑥已知2H2(g)+O2(g)=2H2O(l)△H=-571kJ•mol-1则氢气的燃烧热为△H=-285.5kJ•mol-1
⑦因为常温下白磷可自燃,而氮气须在放电时才与氧气反应,所以非金属性:P>N.
| A. | 只有②④⑥ | B. | 只有①⑤⑥ | C. | 只有②③④ | D. | 只有③⑤⑦ |
13.已知:
①1mol H2分子中化学键断裂时需要吸收436KJ的能量
②1 mol Cl2分子中化学键断裂时需要吸收243 kJ的能量
③由H原子和Cl原子形成1 mol HCl分子时释放431 kJ的能量
对于反应:H2(g)+Cl2(g)═2HCl(g),下列叙述正确的是( )
①1mol H2分子中化学键断裂时需要吸收436KJ的能量
②1 mol Cl2分子中化学键断裂时需要吸收243 kJ的能量
③由H原子和Cl原子形成1 mol HCl分子时释放431 kJ的能量
对于反应:H2(g)+Cl2(g)═2HCl(g),下列叙述正确的是( )
| A. | 反应生成2mol氯化氢气体,吸收248KJ的能量 | |
| B. | 反应生成2mol氯化氢气体,放出183KJ的能量 | |
| C. | 反应物的总能量低于生成物的总能量 | |
| D. | 该反应为吸热反应 |
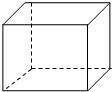 “立方烷”是一种人工合成的烃,其分子为正方体结构,其碳架结构如图所示:
“立方烷”是一种人工合成的烃,其分子为正方体结构,其碳架结构如图所示: .
.