题目内容
按要求完成下列问题:
(1)写出基态铁原子的电子排布式 ,Mg2+的电子排布图 .
(2)下列分子若是手性分子,请用“*”标出其手性碳原子.
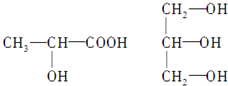
(3)指出配合物K3[Co(CN)6]中的中心离子、配体及其配位数: 、 、 .
(4)判断BCl3分子的空间构型、中心原子成键时采取的杂化轨道类型及分子中共价键的键角 、 、 .
(1)写出基态铁原子的电子排布式
(2)下列分子若是手性分子,请用“*”标出其手性碳原子.
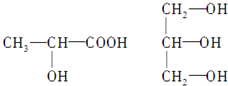
(3)指出配合物K3[Co(CN)6]中的中心离子、配体及其配位数:
(4)判断BCl3分子的空间构型、中心原子成键时采取的杂化轨道类型及分子中共价键的键角
考点:原子核外电子排布,配合物的成键情况,原子轨道杂化方式及杂化类型判断,常见有机化合物的结构
专题:原子组成与结构专题,化学键与晶体结构
分析:(1)Fe元素为26号元素,原子核外有26个电子,再根据核外电子排布规律来写;Mg2+含有10个电子,核外电子排布式为1s22s22p6,以此写出排布图;
(2)连接4个不同原子或原子团的碳原子为手性碳原子;
(3)根据配合物K3[Co(CN)6]结构分析中心离子为Co3+、配体为CN-、配位数为6;
(4)计算BCl3分子的中心原子B的价层电子对数,确定VSEPR模型和空间构型,杂化轨道数目和类型、根据空间构性确定键角.
(2)连接4个不同原子或原子团的碳原子为手性碳原子;
(3)根据配合物K3[Co(CN)6]结构分析中心离子为Co3+、配体为CN-、配位数为6;
(4)计算BCl3分子的中心原子B的价层电子对数,确定VSEPR模型和空间构型,杂化轨道数目和类型、根据空间构性确定键角.
解答:
解:(1)Fe元素为26号元素,原子核外有26个电子,所以核外电子排布式为:1s22s22p63s23p63d64s2,Mg2+含有10个电子,核外电子排布式为1s22s22p6,电子排布图为 ,
,
故答案为:1s22s22p63s23p63d64s2; ;
;
(2)连接4个不同原子或原子团的碳原子为手性碳原子,所以手性碳原子分别为:
 ,
,
故答案为: .
.
(3)根据配合物K3[Co(CN)6]结构分析,含有空轨道的金属阳离子为中心离子,所以中心离子为Co3+、有孤对电子的原子或离子为配体,所以配体为CN-、配位数就是配体的个数,所以配位数为6,
故答案为:Co3+、CN-、6;
(4)BCl3分子的中心原子B的价层电子对数=3+
(3-3×1)=3,孤电子对数为0,因此空间构型和VSEPR模型一致,为平面正三角形,因此键角为120°,杂化类型为sp2杂化,
故答案为:平面正三角形;sp2;120°.
 ,
,故答案为:1s22s22p63s23p63d64s2;
 ;
;(2)连接4个不同原子或原子团的碳原子为手性碳原子,所以手性碳原子分别为:
 ,
,故答案为:
 .
.(3)根据配合物K3[Co(CN)6]结构分析,含有空轨道的金属阳离子为中心离子,所以中心离子为Co3+、有孤对电子的原子或离子为配体,所以配体为CN-、配位数就是配体的个数,所以配位数为6,
故答案为:Co3+、CN-、6;
(4)BCl3分子的中心原子B的价层电子对数=3+
| 1 |
| 2 |
故答案为:平面正三角形;sp2;120°.
点评:本题考查了核外电子排布式(图)、配合物和分子结构,具有很强的综合性,难度中等,熟练掌握原子核外电子排布规律、价层电子对互斥理论和轨道杂化理论是解题的关键.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
已知某元素+3价离子的电子排布为:1s22s22p63s23p63d5,该元素在周期表中的位置正确的是( )
| A、第三周期Ⅷ族,p区 |
| B、第三周期ⅤB族,ds区 |
| C、第四周期Ⅷ族,d区 |
| D、第四周期ⅤB族,f区 |
下列各项叙述中,正确的是( )
| A、镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态 |
| B、同一原子中,2p,3p,4p能级的轨道依次增多 |
| C、所有原子任一能层的s电子云轮廓图都是球形,但球的半径大小不同 |
| D、CH2O和ClO4-的中心原子上都含有孤对电子 |
下列分子中所有原子都满足最外层8电子结构的是( )
| A、光气(COCl2) |
| B、五氯化磷(PCl5) |
| C、氟利昂(CF2Cl2) |
| D、三氟化硼(BF3) |
下列与有机物相关的叙述正确的是( )
| A、CH4O与C2H6O一定互为同系物 |
| B、1mol C6H6(苯)中含有3mol碳碳双键 |
| C、用浓硝酸与蛋白质的颜色反应鉴别部分蛋白质 |
| D、向乙酸乙酯中加入NaOH 溶液,振荡,分液分离除去乙酸乙酯中的少量乙酸 |