题目内容
下列各项叙述中,正确的是( )
| A、镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态 |
| B、同一原子中,2p,3p,4p能级的轨道依次增多 |
| C、所有原子任一能层的s电子云轮廓图都是球形,但球的半径大小不同 |
| D、CH2O和ClO4-的中心原子上都含有孤对电子 |
考点:原子核外电子排布
专题:原子组成与结构专题
分析:A、原子由基态转化为激发态,吸收能量;
B、相同能级所含的原子轨道数相等;
C、S电子云轮廓图都是球形,但能层越大,球的半径越大;
D、CH2O的中心原子上孤对电子对数=
(4-2×1-1×2)=0,ClO4-的中心原子上孤对电子对数=
(7+1-4×2)=0.
B、相同能级所含的原子轨道数相等;
C、S电子云轮廓图都是球形,但能层越大,球的半径越大;
D、CH2O的中心原子上孤对电子对数=
| 1 |
| 2 |
| 1 |
| 2 |
解答:
解:A、镁原子由1s22s22p63s2→1s22s22p63p2时,原子吸收能量,由基态转化成激发态,故A错误;
B、同一原子中,2p,3p,4p能级的轨道都是3个,故B错误;
C、所有原子任一能层的S电子云轮廓图都是球形,能层越大,球的半径越大,故C正确;
D、CH2O的中心原子上孤对电子对数=
(4-2×1-1×2)=0,ClO4-的中心原子上孤对电子对数=
(7+1-4×2)=0,因此都不含孤电子对,故D错误;
故选C.
B、同一原子中,2p,3p,4p能级的轨道都是3个,故B错误;
C、所有原子任一能层的S电子云轮廓图都是球形,能层越大,球的半径越大,故C正确;
D、CH2O的中心原子上孤对电子对数=
| 1 |
| 2 |
| 1 |
| 2 |
故选C.
点评:本题考查电子云、原子核外电子的排布等知识点,综合性较强,难度一般,注意分子、离子中心原子孤电子对的计算方法..

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案
相关题目
下列各基态原子和离子的电子排布式错误的是( )
| A、Ca2+ 1s22s22p63s23p6 |
| B、F- 1s22s23p6 |
| C、S2- 1s22s22p63s23p4 |
| D、Ar 1s22s22p63s23p6 |
下列几种元素的表达式错误的是( )
A、F-的电子排布图: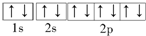 |
B、Na+的结构示意图: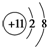 |
| C、Mg2+的电子排布式:1s22s22p6 |
| D、Cr的简化电子排布式:[Ar]3d44s2 |
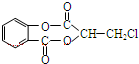 )在一定条件下可以发生如图所示的转化(其他产物和水已略去).
)在一定条件下可以发生如图所示的转化(其他产物和水已略去).
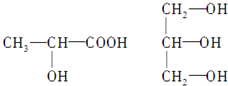
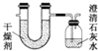 已知某种燃料含有碳、氢二种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并将产生的气体全部通过图示装置,得到如表所列的实验数据(产生的气体完全被吸收).
已知某种燃料含有碳、氢二种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并将产生的气体全部通过图示装置,得到如表所列的实验数据(产生的气体完全被吸收). ,该氧化物的化学式为
,该氧化物的化学式为