题目内容
19.下列可逆反应达到平衡后,加压或降低温度都可使平衡向逆方向移动的是( )| A. | 2NO2(g)?N2O4(g)(正反应为放热反应) | |
| B. | 2SO3(g)?2SO2(g)+O2(g)(正反应为吸热反应) | |
| C. | H2(g)+I2(g)?2HI (g)(正反应为放热反应) | |
| D. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g) (正反应为放热反应) |
分析 根据化学平衡移动原理:增大压强,化学平衡向着气体系数和减小的方向进行;降低温度,化学平衡向着放热方向进行.
解答 解:A、该反应的正反应为气体体积减小的放热反应,加压化学平衡向着正反应方向进行,降低温度可使平衡向正反应方向移动,故A错误;
B、该反应的正反应为气体体积增大的吸热反应,加压化学平衡向着逆向进行,降低温度,化学平衡向着逆反应方向进行,故B正确;
C、该反应的正反应为气体体积不变的放热反应,加压化学平衡不会发生移动,升高温度可使平衡向逆反应方向移动,故C错误;
D、该反应的正反应为气体体积增大的放热反应,加压温度可使平衡向逆反应方向移动,降低温度可使平衡向正反应方向移动,故D错误.
故选B.
点评 本题考查学生温度和压强对化学平衡移动的影响知识,注意知识的梳理和归纳是解题的关键,难度不大.

练习册系列答案
 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
7.下列离子方程式书写正确的是( )
| A. | 向氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl- | |
| B. | 铁钉放入硫酸铜溶液中:Fe+3Cu2+=2Fe3++3Cu | |
| C. | 三氯化铁溶液中加入铁粉:Fe3++Fe=2 Fe2+ | |
| D. | NaHCO3溶液与盐酸反应:HCO3-+H+=CO2↑+H2O |
14.在一定温度固定容积的密闭容器中充入2molNO2发生反应2NO2(g)?N2O4(g)达到平衡后,在恒温恒容条件下,再向容器内通入2molNO2,又达到新平衡时NO2的体积分数( )
| A. | 不变 | B. | 增大 | C. | 减小 | D. | 无法判断 |
4.下列分散系最稳定的是( )
| A. | 悬浊液 | B. | 乳浊液 | C. | 胶体 | D. | 溶液 |
11.下列鉴别物质的方法能达到目的是( )
| A. | 用加热、称重的方法鉴别Na2CO3固体和NaHCO3固体 | |
| B. | 用焰色反应鉴别NaCl固体和NaOH固体 | |
| C. | 某溶液中滴加盐酸能产生无色气体,该气体能使澄清石灰水变浑浊,则原溶液中一定含CO32- | |
| D. | 向某溶液中加入BaCl2溶液出现白色沉淀,再加入HCl溶液,白色沉淀不溶解,则该溶液中肯定有SO42- |
6.将54.4g铁粉和氧化铁的混合物中加入200mL的稀硫酸,恰好完全反应,放出氢气4.48L(标准状况).反应后的溶液中滴加KSCN不显红色,且无固体剩余物,求混合物中 铁的质量( )
| A. | 22.4g | B. | 11.2g | C. | 20.4g | D. | 5.6g |
 增大。
增大。
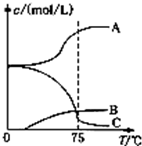 氯酸钠(NaClO3)是无机盐工业的重要产品之一.
氯酸钠(NaClO3)是无机盐工业的重要产品之一.