题目内容
5.有机化工原料1,4-二苯基-1,3-丁二烯及某抗结肠炎药物有效成分的合成路线如图(部分反应略去试剂和条件):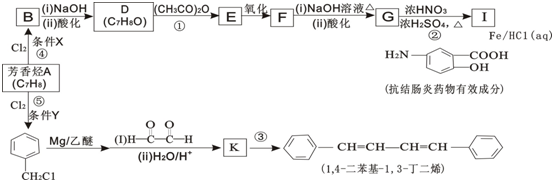
已知:
Ⅰ.R-Cl$\stackrel{Mg/乙醚}{→}$RMgCl$→_{(ii)H_{2}O/H+}^{(i)R′CHO}$
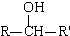 (R、R′表示烃基)
(R、R′表示烃基)Ⅱ.
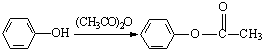
Ⅲ.
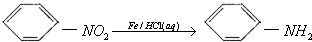
Ⅳ.
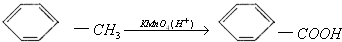
(1)抗结肠炎药物有效成分分子中的含氧官能团名称是羧基、羟基.
(2)D的结构简式是

(3)写出F与NaOH反应的化学方程式
 .
.(4)下列说法正确的是BD(填选项字母).
A.④的反应条件X和⑤的反应条件Y完全相同
B.①②④⑤反应类型相同
C.G不可以发生缩聚反应
D.设计D→E和F→G两步反应的目的是防止酚羟基被氧化
(5)检验
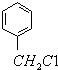 有氯原子的方法是将少量样品与NaOH溶液在试管中混合共热,充分反应并冷却后,向溶液中加稀HNO3酸化,再滴加AgNO3溶液,若有白色沉淀,则证明有氯元素.
有氯原子的方法是将少量样品与NaOH溶液在试管中混合共热,充分反应并冷却后,向溶液中加稀HNO3酸化,再滴加AgNO3溶液,若有白色沉淀,则证明有氯元素.(6)③的化学方程式是
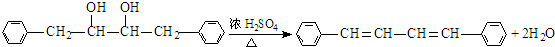 .
.(7)E有多种同分异构体,符合下列条件的同分异构体有23种
①结构中有苯环
②与E有相同的官能团
(8)1,4-二苯基-1,3-丁二烯有多种同分异构体,写出符合下列条件的同分异构体的结构简式:
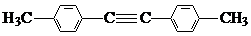
a.结构中有两个苯环,无其它环状结构
b.苯环上的一硝基取代产物有两种
c.其核磁共振氢谱有3种峰,峰面积之比为3:2:2.
分析 芳香烃A(C7H8)为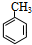 ,与氯气在光照条件下发生取代反应生成
,与氯气在光照条件下发生取代反应生成 ,
, 发生信息Ⅰ中反应生成K为
发生信息Ⅰ中反应生成K为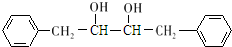 ;由
;由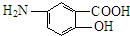 逆推可知I为
逆推可知I为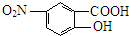 ,G为
,G为 ,D发生信息Ⅱ中的反应得到E,E氧化得到F,F酸化得到G,D→E的转化目的防止酚羟基被氧化,则E为
,D发生信息Ⅱ中的反应得到E,E氧化得到F,F酸化得到G,D→E的转化目的防止酚羟基被氧化,则E为 ,F为
,F为 ,则D为
,则D为 ,B为
,B为 ,据此解答.
,据此解答.
解答 解:芳香烃A(C7H8)为 ,与氯气在光照条件下发生取代反应生成
,与氯气在光照条件下发生取代反应生成 ,
, 发生信息Ⅰ中反应生成K为
发生信息Ⅰ中反应生成K为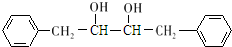 ;由
;由 逆推可知I为
逆推可知I为 ,G为
,G为 ,D发生信息Ⅱ中的反应得到E,E氧化得到F,F酸化得到G,D→E的转化目的防止酚羟基被氧化,则E为
,D发生信息Ⅱ中的反应得到E,E氧化得到F,F酸化得到G,D→E的转化目的防止酚羟基被氧化,则E为 ,F为
,F为 ,则D为
,则D为 ,B为
,B为 .
.
(1)抗结肠炎药物有效成分分子中的含氧官能团名称是:羧基、羟基,故答案为:羧基、羟基;
(2)D的结构简式是 ,故答案为:
,故答案为: ;
;
(3)F与NaOH反应的化学方程式: ,
,
故答案为: ;
;
(4)A.④的反应条件为催化剂,⑤的反应条件为光照,故A错误;
B.①②④⑤均属于取代反应,故B正确;
C.G为 ,含有羧基、羟基,可以发生缩聚反应,故C错误;
,含有羧基、羟基,可以发生缩聚反应,故C错误;
D.设计D→E和F→G两步反应的目的是防止酚羟基被氧化,故D正确,
故选:BD;
(5)检验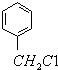 有氯原子的方法是:将少量样品与NaOH溶液在试管中混合共热,充分反应并冷却后,向溶液中加稀HNO3酸化,再滴加AgNO3溶液,若有白色沉淀,则证明有氯元素,
有氯原子的方法是:将少量样品与NaOH溶液在试管中混合共热,充分反应并冷却后,向溶液中加稀HNO3酸化,再滴加AgNO3溶液,若有白色沉淀,则证明有氯元素,
故答案为:将少量样品与NaOH溶液在试管中混合共热,充分反应并冷却后,向溶液中加稀HNO3酸化,再滴加AgNO3溶液,若有白色沉淀,则证明有氯元素;
(6)③的化学方程式是 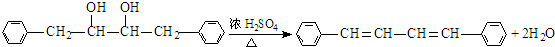 ,
,
故答案为: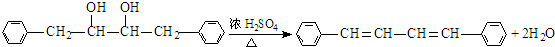 ;
;
(7)E为 ,其同分异构体符合:①结构中有苯环,②与E有相同的官能团,含有酯基,
,其同分异构体符合:①结构中有苯环,②与E有相同的官能团,含有酯基,
若只有1个取代基,为-OOCCH2CH3,或者-COOCH2CH3,或者-CH2OOCCH3,或者-CH2COOCH3,或者-CH2CH2OOCH,或者-CH(CH3)OOCH,有6种,
若有2个取代基,为-CH3、-OOCH2CH3,或-CH3、-CH2OOCH,或-CH3、-COOCH3,或者-CH2CH3、-OOCH,各有邻、间、对3种(包含E),不含E有11种,
若有3个取代基,为2个-CH3、-OOCH,2个-CH3处于邻位,-OOCH有2种位置,2个-CH3处于间位,-OOCH有3种位置,2个-CH3处于对位,-OOCH有1种位置,有6种,
故符合条件的同分异构体共有23种,
故答案为:23;
(8)1,4-二苯基-1,3-丁二烯有多种同分异构体中,符合下列条件:a.结构中有两个苯环,无其它环状结构,b.苯环上的一硝基取代产物有两种,c.其核磁共振氢谱有3种峰,峰面积之比为3:2:2,符合条件的同分异构体为: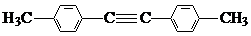
故答案为: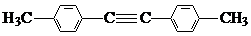
点评 本题考查有机物推断,需要学生对给予的信息进行利用,能较好的考查学生自学能力,需要学生熟练掌握官能团性质与转化,结合转化关系中有机物的结构利用逆推法进行推断,对学生的推理有一定的要求,(7)中同分异构体数目判断为易错点,难度中等.

| A. | 醋酸的电离:CH3COOH?CH3COO-+H+ | |
| B. | 碳酸氢钠在水溶液中的电离:NaHCO3?Na++HCO3- | |
| C. | 氯化铵的水解:NH4++H2O?NH4OH+H+ | |
| D. | 碳酸钙的溶解平衡:CaCO3(s)?Ca2+(aq)+CO32-(aq) |
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
| A. | 常温下,2.24LCH4中含有0.4NA个共价键 | |
| B. | 100mL1mol•L-1NaAlO2溶液中含有0.1NA个AlO2- | |
| C. | 常温常压下,5.6gFe与足量稀硝酸反应,转移电子0.2NA个电子 | |
| D. | 标准状况下,1.12L1H2和0.2g2H2均含有0.1NA个质子 |
| A. | 硅胶多孔,吸水能力强,是最好的食品干燥剂 | |
| B. | 硅的化学性质不活泼,常温下不与任何物质起反应 | |
| C. | 硅的导电性能介于导体和绝缘体之间,是良好的半导体材料 | |
| D. | Na2SiO3溶液俗称水玻璃,可用作木材防火剂 |
 在两支试管中分别加入3mL稀盐酸(均足量),将两个各装有0.3g NaHCO3和Na2CO3粉末的小气球分别套在两支试管口上.将气球内的NaHCO3和Na2CO3同时倒入试管中.
在两支试管中分别加入3mL稀盐酸(均足量),将两个各装有0.3g NaHCO3和Na2CO3粉末的小气球分别套在两支试管口上.将气球内的NaHCO3和Na2CO3同时倒入试管中.(1)①Ⅰ试管和Ⅱ试管中分别发生反应的离子方程式:HCO3-+H+═CO2↑+H2O、CO32-+2H+═CO2↑+H2O
②两支试管中的现象为两支试管中都产生气泡,但装有NaHCO3的试管中反应速率快得多
③两试管中气球大小(不包含试管)体积之比约为Ⅰ:Ⅱ=42:53(填最简单整数比)
④甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3粉末的试管温度有升高.由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应.甲得出的结论是否正确不正确.(填“正确”或“不正确”)
(2)为研究是吸热还是放热反应,继续进行了下列实验(每次实验各做3次平行实验,取平均值):
| 序号 | 试剂1 | 试剂2 | 混合前温度 | 混合后最高或最低温度 |
| ① | 50mL水 | 2.5gNaHCO3固体 | 20℃ | 18.5℃ |
| ② | 35mL水 | 3.2gNa2CO3固体 | 20℃ | 23.3℃ |
| ③ | 35mL稀盐酸 | 含2.5gNaHCO3的 饱和溶液15mL | 20℃ | 18.8℃ |
| ④ | 50mL稀盐酸 | 含3.2gNa2CO3的 饱和溶液15mL | 20℃ | 21.2℃ |
| ⑤ | 50mL稀盐酸 | 2.5gNaHCO3固体 | 20℃ | 17.4℃ |
| ⑥ | 50mL稀盐酸 | 3.2gNa2CO3固体 | 20℃ | 24.4℃ |
该实验中所用的仪器除试管、药匙(或V形纸槽)、气球、环形玻璃搅拌棒、胶头滴管、烧杯、量筒、保温瓶外,还需要的仪器名称为温度计和托盘天平.
通过上述实验可得出三条结论:
a:NaHCO3的溶解是吸热(吸热或放热)过程
b:Na2CO3的饱和溶液和盐酸的反应是放热(吸热或放热)反应;
C:NaHCO3的饱和溶液和盐酸的反应是吸热(吸热或放热)反应.
| A. | 所有的化学反应都伴随着物质变化和能量变化 | |
| B. | 断裂化学键要吸收能量、形成化学键要释放能量是化学反应中能量变化的主要原因 | |
| C. | 吸热反应是一定需要加热才能发生的反应 | |
| D. | 根据反应物总能量和生成物总能量的相对大小可判断反应是释放能量还是吸收能量 |

 ,
,
 合成
合成 的流程图,(注明反应条件):
的流程图,(注明反应条件): $→_{△}^{NaOH水溶液}$
$→_{△}^{NaOH水溶液}$ $→_{△}^{催化剂}$
$→_{△}^{催化剂}$