题目内容
5.浅绿色的Fe(NO3)2溶液中,存在如下平衡:Fe2++2H2O?Fe(OH)2+2H+若在此溶液中加入盐酸后,用文字说明溶液颜色的变化及原因溶液有浅绿色变为棕黄色,Fe2+被(H+和NO3-的组合)氧化为Fe3+.分析 二价铁离子有还原性,硝酸有强氧化性,亚铁离子和硝酸能发生氧化还原反应生成三价铁离子,据此分析.
解答 解:浅绿色的Fe(NO3)2溶液中,存在如下平衡:Fe2++2H2O?Fe(OH)2+2H+,若在此溶液中加入盐酸,二价铁离子有还原性,硝酸有强氧化性,亚铁离子和硝酸能发生氧化还原反应生成三价铁离子,溶液有浅绿色变为棕黄色;
故答案为:溶液有浅绿色变为棕黄色,Fe2+被(H+和NO3-的组合)氧化为Fe3+.
点评 本题考查了影响盐类水解的因素、氧化还原反应,题目难度不大,注意酸性条件下,硝酸根离子和亚铁离子能发生氧化还原反应而使亚铁离子生成铁离子,属于易错题.

练习册系列答案
相关题目
2.下列能说明氯元素比硫元素非金属性强的是( )
①HC1比H2S稳定
②HClO4酸性比H2SO4强
③Cl2能与H2S反应生成s
④Cl2比S更易与H2化合生成相应气态氢化物
⑤盐酸是强酸,而氢硫酸是弱酸.
①HC1比H2S稳定
②HClO4酸性比H2SO4强
③Cl2能与H2S反应生成s
④Cl2比S更易与H2化合生成相应气态氢化物
⑤盐酸是强酸,而氢硫酸是弱酸.
| A. | ①②③④⑤ | B. | ①②④⑤ | C. | ①②③④ | D. | ②④⑤ |
10.将一小块金属钠长期露置于空气中,最终的产物是( )
| A. | Na2CO3 | B. | Na2O | C. | NaOH | D. | Na2CO3•10H2O |
17.根据化学反应的实质--旧键的断裂和新键的形成,判断下列变化不属于化学变化的是( )
| A. | 固态硫S8加热变成S2蒸气 | B. | 金刚石在一定条件下转化为石墨 | ||
| C. | 干冰变成CO2气体 | D. | Na2O转化为Na2O2 |
14.下列各组中的物质均能发生加成反应的是( )
| A. | 乙烯和乙醇 | B. | 苯和乙醛 | C. | 乙酸和氯乙烯 | D. | 丙醛和丙烷 |
15.25℃时,0.1mol•L-1CH3COONa溶液的pH=a,下列说法错误的是( )
| A. | 该溶液中由水电离出的c(OH-)=10a-14 | |
| B. | 加水稀释,$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}$减小 | |
| C. | 该温度下,pH=a的NaOH溶液的物质的量浓度小于0.1mol•L-1 | |
| D. | 加入等浓度、等体积的CH3COOH溶液,所得溶液中c(CH3COO-)+c(CH3COOH)=2c(Na+) |
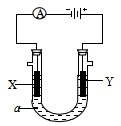 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: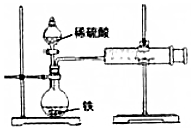 某小组的同学们利用如图装置,探究不同条件对铁与酸反应速率的影响.
某小组的同学们利用如图装置,探究不同条件对铁与酸反应速率的影响. $\stackrel{H_{2}O}{→}$
$\stackrel{H_{2}O}{→}$
 $\stackrel{2H}{→}$
$\stackrel{2H}{→}$ ,失去的氢原子再和氧原子结合成水分子
,失去的氢原子再和氧原子结合成水分子 +$\stackrel{O_{2}}{→}$
+$\stackrel{O_{2}}{→}$ $\stackrel{-H_{2}O}{→}$
$\stackrel{-H_{2}O}{→}$ 反应过程中为先加氧后脱水
反应过程中为先加氧后脱水