题目内容
6.反应NO+O2+NO2+H2O→HNO3(未配平),当氧化剂与还原剂的物质的量之比为1:3时,此反应各物质化学计量数(系数)之比为( )| A. | 4:9:24:14:28 | B. | 1:2:5:3:6 | C. | 8:9:12:10:20 | D. | l:l:l:l:2 |
分析 反应中NO→HNO3,氮元素化合价升高3;NO2→HNO3,氮元素化合价升高1;O2→HNO3,氧元素化合价降低2;
还原剂为:NO、NO2,氧化剂为:O2,依据氧化还原反应得失电子守恒,原子个数守恒,氧化剂与还原剂的物质的量之比为1:3,利用代入法解答.
解答 解:A.4NO+9O2+24NO2+14H2O→28HNO3,氧化剂物质的量为9,还原剂物质的量为:4+24=28,二者物质的量之比为9:28,故A错误;
B.1NO+2O2+5NO2+3H2O→6HNO3,氧化剂物质的量为2,还原剂物质的量为:1+5=6,二者物质的量之比为2:6=1:3,故B正确;
C.8NO+9O2+12NO2+10H2O→20HNO3,氧化剂物质的量为9,还原剂物质的量为:8+12=20,二者物质的量之比为9:20=9:20,故C错误;
D.1NO+1O2+1NO2+1H2O→2HNO3,氧化剂物质的量为1,还原剂物质的量为:1+1=2,二者物质的量之比为1:2,故D错误;
故选B.
点评 本题考查了氧化还原反应电子守恒、氧化剂和还原剂物质的量之比,主要是元素化合价变化和氧化剂、还原剂的分析判断,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
2.下列有关影响化学反应速率的因素的说法错误的是( )
| A. | 影响化学反应速率的主要因素是内因,即反应物本身的性质 | |
| B. | 增大反应物浓度,活化分子百分数不变,单位体积内活化分子数增多 | |
| C. | 升高温度,活化分子百分数增大,分子有效碰撞的频率增大,化学反应速率加快 | |
| D. | 使用正催化剂,活化分子百分数不变,但是反应速率加快 |
3.将amol/L Al2(SO4)3和钾离子浓度为2bmol/L的K2SO4混合溶液500mL加水稀释到2L,则稀释后的溶液中SO42-的浓度为( )
| A. | $\frac{(a+b)}{4}$ mol/L | B. | 4(3a+b) mol/L | C. | 4(a+b) mol/L | D. | $\frac{(3a+b)}{4}$mol/L |
14.合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料.从天然气获得合成气过程中可能发生的反应有:
①CH4(g)+H2O(g)?CO(g)+3H2(g)△H1=206.1kJ•mol-1
②CH4(g)+CO2(g)?2CO(g)+2H2(g)△H2=247.3kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3
请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示.反应进行的前5min内,v(H2)=0.3mol/(L•min);10min时,改变的外界条件可能是升高温度或充入水蒸气.
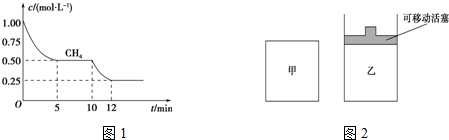
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等.在相同温度下发生反应②,并维持反应过程中温度不变.
①可以判断甲容器中反应已达平衡状态的是bd.
a.生成CH4的速率是生成CO的速率的2倍
b.容器内压强保持不变
c.容器内气体的密度保持不变
d.容器内各气体的浓度保持不变
②甲乙两容器中反应达到平衡时,下列说法正确的是ab.
a.化学反应速率:v (甲)>v (乙)
b.甲烷的转化率:α(甲)<α(乙)
c.压强:P(甲)=P (乙)
(3)反应③中△H3=-41.2kJ/mol kJ•mol-1.800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见如表:
此时反应③中正、逆反应速率的关系是a(填代号).
a.v(正)>v (逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断.
①CH4(g)+H2O(g)?CO(g)+3H2(g)△H1=206.1kJ•mol-1
②CH4(g)+CO2(g)?2CO(g)+2H2(g)△H2=247.3kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3
请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示.反应进行的前5min内,v(H2)=0.3mol/(L•min);10min时,改变的外界条件可能是升高温度或充入水蒸气.

(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等.在相同温度下发生反应②,并维持反应过程中温度不变.
①可以判断甲容器中反应已达平衡状态的是bd.
a.生成CH4的速率是生成CO的速率的2倍
b.容器内压强保持不变
c.容器内气体的密度保持不变
d.容器内各气体的浓度保持不变
②甲乙两容器中反应达到平衡时,下列说法正确的是ab.
a.化学反应速率:v (甲)>v (乙)
b.甲烷的转化率:α(甲)<α(乙)
c.压强:P(甲)=P (乙)
(3)反应③中△H3=-41.2kJ/mol kJ•mol-1.800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见如表:
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
a.v(正)>v (逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断.
1.下列有关金属的腐蚀及防护的说法不正确的是( )
| A. | 金属发生腐蚀的实质是:M-ne-=Mn+ | |
| B. | 金属发生的电化学腐蚀比化学腐蚀要普遍得多 | |
| C. | 防止金属生锈可以通过涂油漆、镀金属等方法在其表面覆盖一层保护膜 | |
| D. | 在钢铁上连接一个铜块可以防止钢铁生锈 |
11.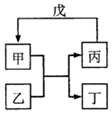 甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各物质中,不满足如图转化关系的是( )
甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各物质中,不满足如图转化关系的是( )
 甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各物质中,不满足如图转化关系的是( )
甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各物质中,不满足如图转化关系的是( ) | 甲 | 乙 | 丙 | 戊 | |
| ① | SiO2 | NaOH | Na2SiO3 | CO2 |
| ② | Fe | H2O | Fe2O3 | H2 |
| ③ | Al(OH)3 | NaOH溶液 | NaAlO2溶液 | 过量CO2 |
| ④ | Na2O2 | CO2 | O2 | Na |
| A. | ①③ | B. | ①② | C. | ②④ | D. | ①④ |
18.把17.1g Ba(OH)2固体分别加入到100mL 1mol/L的下列物质的溶液中,溶液导电能力变化最小的是( )
| A. | 醋酸 | B. | 碳酸钠溶液 | C. | CuSO4溶液 | D. | KCl溶液 |
16.化学在生产和日常生活中有着重要的作用,下列有关说法不正确的是( )
| A. | 硅酸钠的水溶液俗称水玻璃,可用作木材防火剂 | |
| B. | “地沟油”经过加工处理后,可以用来制肥皂 | |
| C. | 含磷污水是很好的肥料,可灌溉庄稼,可直接排放到自然界水体中 | |
| D. | Fe2O3常用于生产红色油漆和涂料 |