题目内容
18.把17.1g Ba(OH)2固体分别加入到100mL 1mol/L的下列物质的溶液中,溶液导电能力变化最小的是( )| A. | 醋酸 | B. | 碳酸钠溶液 | C. | CuSO4溶液 | D. | KCl溶液 |
分析 n[Ba(OH)2]=$\frac{17.1g}{171g/mol}$=0.1mol,溶液中溶质的物质的量=1mol/L×0.1L=0.1mol,溶液导电性强弱与离子浓度成正比,离子浓度变化最小,则溶液导电性变化最小,据此分析解答.
解答 解:n[Ba(OH)2]=$\frac{17.1g}{171g/mol}$=0.1mol,溶液中溶质的物质的量=1mol/L×0.1L=0.1mol,溶液导电性强弱与离子浓度成正比,离子浓度变化最小,则溶液导电性变化最小,
A.醋酸是弱电解质,醋酸溶液中离子浓度较小,则醋酸溶液导电性较弱,加入氢氧化钡后生成强电解质醋酸钡,导致离子浓度变化较大,溶液导电性变化较大,故A不选;
B.碳酸钠是强电解质,离子浓度较大,导电性较强,加入氢氧化钡后生成碳酸钡和氢氧化钠,NaOH仍然是强电解质,离子浓度变化不大,溶液导电性变化不大,故B选;
C.硫酸铜是强电解质,离子浓度较大,导电性较强,加入氢氧化钡后生成硫酸钡沉淀和水,离子浓度变化较大,溶液导电性变化较大,故C不选;
D.KCl是强电解质,离子浓度较大,导电性较强,加入氢氧化钡后二者不反应,离子浓度变化较大,溶液导电性变化较大,故D不选;
故选B.
点评 本题考查溶液导电性强弱判断,为高频考点,侧重考查学生分析判断能力,明确溶液导电性强弱影响因素及物质之间的反应是解本题关键,溶液导电性强弱与离子浓度成正比,与电解质强弱无关.

练习册系列答案
相关题目
14.下列各组离子能在指定溶液中,大量共存的是( )
| A. | 含大量SO2的溶液中:NH4+、F-、HCO3-、ClO- | |
| B. | 能使淀粉碘化钾试纸变蓝的溶液:Cl-、Na+、S2-、NH4+ | |
| C. | $\frac{{k}_{w}}{c({H}^{+})}$=10-13mol/L的溶液中:Al3+、Fe3+、NO3-、ClO4- | |
| D. | 滴入KSCN溶液显红色的溶液中:NO3+、Na+、AlO2-、K+ |
9.二甲醚(CH3OCH3)是一种应用前景广阔的清洁燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
由上述数据计算△H1=-99kJ/mol.
(2)该工艺的总反应为3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H
该反应△H=-263kJ/mol,化学平衡常数K=K12•K2•K3(用含K1、K2、K3的代数式表示).
(3)下列措施中,能提高CH3OCH3产率的有AD.
A.分离出二甲醚 B.升高温度
C.改用高效催化剂 D.增大压强
(4)工艺中反应①和反应②分别在不同的反应器中进行,无反应③发生.该工艺中反应③的发生提高了CH3OCH3的产率,原因是反应③消耗了反应②中的产物H2O,使反应②的化学平衡右移.
(5)以$\frac{n({H}_{2})}{n(CO)}$=2通入1L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图所示.下列说法正确的是CD.
A.该反应的△H>0
B.若在p2和316℃时反应达到平衡,则CO的转化率小于50%
C.若在p3和316℃时反应达到平衡,H2的转化率等于50%
D.若在p3和316℃时,起始时$\frac{n({H}_{2})}{n(CO)}$=3,则达平衡时CO的转化率大于50%
E.若在p1和200℃时,反应达平衡后保持温度和压强不变,再充入2mol H2和1mol CO,则平衡时二甲醚的体积分数增大
(6)某温度下,将8.0mol H2和4.0mol CO充入容积为2L的密闭容器中,发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g),反应达平衡后测得二甲醚的体积分数为25%,则该温度下反应的平衡常数K=2.25.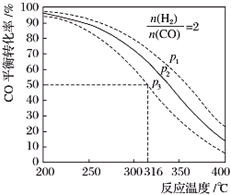
| 编号 | 热化学方程式 | 化学平衡常数 |
| ① | CO(g)+2H2(g)?CH3OH(g)△H1 | K1 |
| ② | 2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-24kJ/mol | K2 |
| ③ | CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41kJ/mol | K3 |
(1)已知反应①中的相关的化学键键能数据如下:
| 化学键 | H-H | C≡O | C-O | H-O | C-H |
| E/(kJ/mol) | 436 | 1076 | 343 | 465 | 413 |
(2)该工艺的总反应为3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H
该反应△H=-263kJ/mol,化学平衡常数K=K12•K2•K3(用含K1、K2、K3的代数式表示).
(3)下列措施中,能提高CH3OCH3产率的有AD.
A.分离出二甲醚 B.升高温度
C.改用高效催化剂 D.增大压强
(4)工艺中反应①和反应②分别在不同的反应器中进行,无反应③发生.该工艺中反应③的发生提高了CH3OCH3的产率,原因是反应③消耗了反应②中的产物H2O,使反应②的化学平衡右移.
(5)以$\frac{n({H}_{2})}{n(CO)}$=2通入1L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图所示.下列说法正确的是CD.
A.该反应的△H>0
B.若在p2和316℃时反应达到平衡,则CO的转化率小于50%
C.若在p3和316℃时反应达到平衡,H2的转化率等于50%
D.若在p3和316℃时,起始时$\frac{n({H}_{2})}{n(CO)}$=3,则达平衡时CO的转化率大于50%
E.若在p1和200℃时,反应达平衡后保持温度和压强不变,再充入2mol H2和1mol CO,则平衡时二甲醚的体积分数增大
(6)某温度下,将8.0mol H2和4.0mol CO充入容积为2L的密闭容器中,发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g),反应达平衡后测得二甲醚的体积分数为25%,则该温度下反应的平衡常数K=2.25.

6.反应NO+O2+NO2+H2O→HNO3(未配平),当氧化剂与还原剂的物质的量之比为1:3时,此反应各物质化学计量数(系数)之比为( )
| A. | 4:9:24:14:28 | B. | 1:2:5:3:6 | C. | 8:9:12:10:20 | D. | l:l:l:l:2 |
13.下列物质:钠、Br2、CO2、SO3、NH3、H2S、硫酸、醋酸、Ba(OH)2、NH3•H2O、氯化钠、硫酸钡、乙醇、盐酸、蔗糖、胆矾,属于电解质、非电解质、强电解质的分别有( )
| A. | 9种、7种、6种 | B. | 9种、5种、6种 | C. | 7种、5种、4种 | D. | 8种、5种、5种 |
10.下列说法正确的是( )
| A. | 铅蓄电池属于二次电池,在充电过程中,阳极质量减小,阴极质量增加 | |
| B. | 常温下,能自发进行的反应,△H一定小于“0” | |
| C. | 一定条件下,使用催化剂能加快反应速率并提高反应物的活化能 | |
| D. | 相同条件下,溶液中Fe3+、Cu2+、Zn2+的氧化性依次减弱 |
8.X、Y、Z、M为4种短周期元素,X、Y位于同周期且原子半径r(X)>r(Y),Y2-与M+的电子层结构相同,Z与X的原子核外最外层电子数相同,Z的单质可制成半导体材料.下列说法不正确的是( )
| A. | 由元素X与Z形成的化合物中只含共价键 | |
| B. | XY2、ZY2、M2Y2的晶体分别属于3种不同类型的晶体 | |
| C. | 单质M的晶体是体心立方堆积,M的配位数是8 | |
| D. | X的氢化物X2H2分子中含有2个σ键和3个π键 |