题目内容
14.合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料.从天然气获得合成气过程中可能发生的反应有:①CH4(g)+H2O(g)?CO(g)+3H2(g)△H1=206.1kJ•mol-1
②CH4(g)+CO2(g)?2CO(g)+2H2(g)△H2=247.3kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3
请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示.反应进行的前5min内,v(H2)=0.3mol/(L•min);10min时,改变的外界条件可能是升高温度或充入水蒸气.
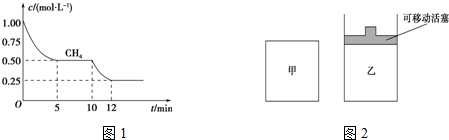
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等.在相同温度下发生反应②,并维持反应过程中温度不变.
①可以判断甲容器中反应已达平衡状态的是bd.
a.生成CH4的速率是生成CO的速率的2倍
b.容器内压强保持不变
c.容器内气体的密度保持不变
d.容器内各气体的浓度保持不变
②甲乙两容器中反应达到平衡时,下列说法正确的是ab.
a.化学反应速率:v (甲)>v (乙)
b.甲烷的转化率:α(甲)<α(乙)
c.压强:P(甲)=P (乙)
(3)反应③中△H3=-41.2kJ/mol kJ•mol-1.800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见如表:
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
a.v(正)>v (逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断.
分析 (1)根据V=$\frac{△c}{△t}$求出CH4的化学反应速率,然后根据反应速率之比等于化学计量数之比,求出H2的化学反应速率;根据图象可知化学反应速率加快,化学平衡正向移动;
(2)①当可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质物质的量、物质的量浓度、百分含量以及由此引起的一系列物理量不变;
②由方程式反应反应向体积增大的方向进行,且甲的压强不乙大,以此判断;
(3)根据盖斯定律可知,①-②可得反应③,再利用Q与K的关系判断反应进行的方向,从而确定正逆反应速率的关系.
解答 解:(1)CH4的化学反应速率为V=$\frac{△c}{△t}$=$\frac{0.5mol/L}{5min}$=0.1mol/(L•min),根据反应速率之比等于化学计量数之比,H2的化学反应速率为0.3mol/(L•min),根据图象可知化学反应速率加快,化学平衡正向移动,根据外界条件对化学反应速率的影响和对化学平衡的影响,可用升高温度或充入水蒸气来达到目的,
故答案为:0.3mol/(L•min);升高温度或充入水蒸气;
(2)①a.生成CH4的速率是生成CO的速率的2倍,正逆反应速率不等,不能得到平衡状态,故错误;
b.反应前后体积不等,则容器内压强保持不变,可说明达到平衡状态,故正确;
c.气体质量不变,容器体积不变,则无论是否达到怕状态,容器内气体的密度都保持不变,故错误;
d.容器内各气体的浓度保持不变,可说明达到平衡状态,故正确.
故答案为:bd;
②a.反应向体积增大的方向移动,甲体积不变,压强增大,乙保持恒压,则甲的压强大,反应速率较大,化学反应速率:v (甲)>v (乙),故正确;
b.甲的压强较大,则增大压强平衡逆向移动,甲中甲烷的转化率较小,甲烷的转化率:α(甲)<α(乙),故正确;
c.由a分析可知甲的压强较大,故错误.
故答案为:ab;
(3)根据盖斯定律可知,①-②可得反应③,则△H3=+206.1kJ/mol-(+247.3kJ/mol)=-41.2kJ/mol,
800℃时,反应③的K=1.0时,正逆反应速率相等,化学平衡不移动;
由表格中的数据可知,气体的体积相同,则物质的量与浓度成正比,Q=$\frac{2.0×2.0}{0.5×8.5}$<K=1.0,该反应向正反应方向移动,则正反应速率大于逆反应速率,即选a,
故答案为:-41.2 kJ/mol;a.
点评 本题考查化学平衡计算、化学平衡影响因素、化学平衡状态判断等知识点,为高频考点,侧重考查学生分析判断及计算能力,只有反应前后改变的物理量才能作为平衡状态的判断依据,注意浓度商与化学平衡常数判断反应平衡移动方向的方法,题目难度中等.


已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O;
②常温下,Ksp(FeS)=6.3×10-18;Ksp(CuS)=6.3×10-36;Ksp(PbS)=8×10-28
③Ⅲ装置中电解硫酸钠溶液,阳极区生成氧气同时产生硫酸,阴极区生成氢气同时产生氢氧化钠.
(1)I中发生反应的离子方程式为SO32-+2ClO3-+2H+=2C1O2+SO42-+H2O.
(2)从滤液中得到NaClO2•3H2O晶体的所需操作依次是bdc(填写序号).
a.蒸馏 b.蒸发浓缩 c.过滤 d.冷却结晶 e.灼烧
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2.表是25℃时HClO2及几种常见弱酸的电离平衡常数:
| 弱酸 | HClO2 | HF | H2CO3 | H2S |
| Ka/mol•L-1 | 1×10-2 | 6.3×10-4 | K1=4.30×10-7 K2=5.60×10-11 | K1=9.1×10-8 K2=l.1×10-12 |
②Na2S是常用的沉淀剂.某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是CuS;常温下,当最后一种离子沉淀完全时(该离子浓度为10-5mol•L-1)此时体系中的S2-的浓度为6.3×10-13mol/L.
(4)Ⅲ装置中若生成气体a的体积为1.12L(标准状况),则转移电子的物质的量为0.2mol.
①酸性氧化物与碱发生反应②弱酸与盐溶液反应可以生成强酸③没有水生成,也没有沉淀和气体生成的复分解反应④两种酸溶液充分反应后的溶液体系为中性 ⑤有单质参加的非氧化还原反应⑥两种氧化物反应的产物有气体.
| A. | ①②③④⑤⑥ | B. | ①②⑤⑥ | C. | ①②③⑤ | D. | ①②③⑤⑥ |
(1)已知:
PCl5(g)═PCl3(g)+Cl2(g)△H1K1
PCl3(g)═P(s)+$\frac{3}{2}$Cl2(g)△H2K2
K1、K2表示该反应的平衡常数.
则PCl5(g)═P(s)+$\frac{5}{2}$Cl2(g)该反应的△H=△H1+△H2(用△H1、△H2表示),反应的平衡常数K=K1×K2(用K1、K2表示).
(2)在210℃时,将4mol PCl3气体充入1L真空恒容密闭容器中发生反应:2PCl3(g)═2P(s)+3Cl2(g)
测得数据如下表:
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(PCl3)/mol | 4 | 2.8 | 2 | 1 | 1 |
①0~30min时,用Cl2表示该反应的反应速率为0.15mol/(L.min);平衡时,PCl3转化率α=75%;该温度下反应的平衡常数K=91.125.
②其它条件保持不变,若上述反应在恒压条件下进行反应,达平衡时测得热量变化数值、平衡常数、PCl3转化率分别为Q′、K′、α′,则Q′>(填“>”“<”或“=”,下同)Q,K′=K,α′>α.
③保持其它条件不变,若向上述平衡体系中再充入1molCl2(g)、1molP(s)和1molPCl3(g),则上述平衡反应正向(填“正向”、“逆向”或“不”)移动.
| 编号 | 热化学方程式 | 化学平衡常数 |
| ① | CO(g)+2H2(g)?CH3OH(g)△H1 | K1 |
| ② | 2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-24kJ/mol | K2 |
| ③ | CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41kJ/mol | K3 |
(1)已知反应①中的相关的化学键键能数据如下:
| 化学键 | H-H | C≡O | C-O | H-O | C-H |
| E/(kJ/mol) | 436 | 1076 | 343 | 465 | 413 |
(2)该工艺的总反应为3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H
该反应△H=-263kJ/mol,化学平衡常数K=K12•K2•K3(用含K1、K2、K3的代数式表示).
(3)下列措施中,能提高CH3OCH3产率的有AD.
A.分离出二甲醚 B.升高温度
C.改用高效催化剂 D.增大压强
(4)工艺中反应①和反应②分别在不同的反应器中进行,无反应③发生.该工艺中反应③的发生提高了CH3OCH3的产率,原因是反应③消耗了反应②中的产物H2O,使反应②的化学平衡右移.
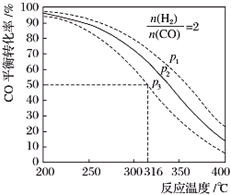
(5)以$\frac{n({H}_{2})}{n(CO)}$=2通入1L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图所示.下列说法正确的是CD.
A.该反应的△H>0
B.若在p2和316℃时反应达到平衡,则CO的转化率小于50%
C.若在p3和316℃时反应达到平衡,H2的转化率等于50%
D.若在p3和316℃时,起始时$\frac{n({H}_{2})}{n(CO)}$=3,则达平衡时CO的转化率大于50%
E.若在p1和200℃时,反应达平衡后保持温度和压强不变,再充入2mol H2和1mol CO,则平衡时二甲醚的体积分数增大
(6)某温度下,将8.0mol H2和4.0mol CO充入容积为2L的密闭容器中,发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g),反应达平衡后测得二甲醚的体积分数为25%,则该温度下反应的平衡常数K=2.25.
| A. | 它们都具有放射性 | |
| B. | 尽管它们结构不同,但它们的化学性质相同 | |
| C. | 它们互为同分异构体 | |
| D. | 它们的原子最外层均为8电子 |
| A. | 4:9:24:14:28 | B. | 1:2:5:3:6 | C. | 8:9:12:10:20 | D. | l:l:l:l:2 |