题目内容
3. 海洋是丰富的资源宝库,通过海水的综合利用可获得许多物质供人类使用.
海洋是丰富的资源宝库,通过海水的综合利用可获得许多物质供人类使用.(1)海水中盐的开发利用:
①海水晒盐,盐田分为贮水池、蒸发池和结晶池.
②工业上常以NaCl、CO2、NH3为原料制取NaHCO3,操作过程中应向饱和食盐水中先通入NH3.
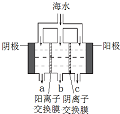
(2)电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过.电渗析法淡化海水示意图如图所示,请回答问题:
①阳极主要电极反应式是2Cl--2e-=Cl2↑.
②在阴极附近产生少量白色沉淀,其成分有Mg(OH)2和CaCO3
③淡水的出口为b(填“a”、“b”或“c”).
(3)用盐卤可以提取溴和镁,提取过程如下:
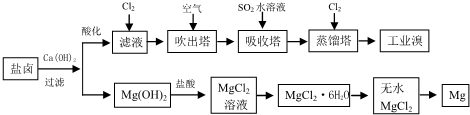
①提取溴的过程中,经过2次Br-→Br2转化的目的是对溴元素进行富集,吸收塔中发生反应的离子方程式是SO2+Br2+2H2O=4H++2Br-+SO42-.用平衡移动原理解释通空气的目的是通入空气将Br2蒸气带出,使Br2(g)?Br2(aq)或Br2+H2O?HBr+HBrO平衡向左移动.
②从MgCl2溶液中得到MgCl2.6H2O晶体的主要操作是蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
③依据上述流程,若将10m3海水(Br含量64mg/L)中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为179.2L(忽略Cl2溶解,Br-80).
分析 (1)①海水晒盐通过蒸发、结晶制取食盐;
②二氧化碳在水中溶解度较小,而氨气极易溶于水,据此判断通入气体的先后顺序;
(2)①依据电渗析法淡化海水示意图分析,阴(阳)离子交换膜仅允许阴(阳)离子通过.所以阴极上是阳离子得到电子发生还原反应,阳极是氯离子失电子发生氧化反应生成氯气;
②阴极是氢离子得到电子发生还原反应,阴极附近氢氧根离子浓度增大,海水中含有碳酸氢根离子、钙离子、Mg2+氢氧根离子和碳酸氢根离子反应生成碳酸根离子与钙离子生成白色沉淀碳酸钙,电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2;
③在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,所以水在b处流出;
(3)海水中加入氢氧化钙沉淀镁离子后过滤,在滤液中通入CL2是将滤液中的Br-氧化为Br2,再利用热的空气将Br2吹出,进入吸收塔与SO2反应,其反应的离子方程式为:SO2+Br2+2H2O=4H++2Br-+SO42-;再通入CL2将Br-氧化为Br2,两次Br-→Br2转化的目的是对溴元素进行富集,氢氧化镁加入盐酸溶解得到氯化镁溶液,氯化镁溶液中得到氯化镁晶体的操作是加热蒸发冷却结晶得到无水氯化镁,电解熔融氯化镁得到金属镁;
①提取溴的过程中,经过2次Br-→Br2转化的目的是更多的得到溴单质,吸收塔内通入的是二氧化硫气体是和溴单质反应生成溴离子,在蒸馏塔中被氯气氧化得到更多的溴单质,通空气的目的是溴单质被空气带出;
②氯化镁溶液中得到氯化镁晶体的操作是加热蒸发、冷却结晶、过滤、洗涤、干燥得到无水氯化镁,电解熔融氯化镁得到金属镁;
③依据离子方程式计算得到需要的氯气体积.
解答 解:(1)①由海水晒盐原理可知,盐田分为贮水池、蒸发池和结晶池,故答案为:结晶;
②由于二氧化碳在水中溶解度较小,而NH3易溶于水,且水溶液显碱性,有利于充分吸收CO2,增大溶液中碳酸氢根的浓度,所以向饱和的氯化钠溶液中先通入氨气,再通入二氧化碳,以NaCl、NH3、CO2和水等为原料制取NaHCO3的化学方程式为:NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl,
故答案为:NH3;
(2)①阴极上是阳离子得到电子发生还原反应,氢离子放电能力大于钠离子,所以电极反应为:2H2O+2e-=H2↑+2OH-或2H++2e-=H2↑,开始时阳极的电极反应式为2Cl--2e-=Cl2↑;
故答案为:2Cl--2e-=Cl2↑;
②阴极是氢离子得到电子发生还原反应,阴极附近氢氧根离子浓度增大,海水中含有碳酸氢根离子、钙离子,氢氧根离子和碳酸氢根离子反应生成碳酸根离子与钙离子生成白色沉淀碳酸钙,生成碳酸钙沉淀的离子方程式为:Ca2++OH-+HCO3-=CaCO3↓+H2O,电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,
故答案为:Mg(OH)2;
③在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,通过用一段时间海水中的 阴阳离子在两个电极放电,所以水在b处流出,
故答案为:b;
(3)①依据利用海水可以提取溴和镁,流程中提取溴的过程中,经过2次Br-→Br2转化的目的是更多的得到溴单质,提取过程对溴元素进行富集;吸收塔内通入的是二氧化硫气体是和溴单质反应生成溴离子,在蒸馏塔中被氯气氧化得到更多的溴单质,吸收塔中反应的离子方程式为;SO2+Br2+2H2O=4H++2Br-+SO42-;通入空气将Br2蒸气带出,使Br2(g)?Br2(aq)或Br2+H2O?HBr+HBrO平衡向左移动,
故答案为:对溴元素进行富集;SO2+Br2+2H2O=4H++2Br-+SO42-;通入空气将Br2蒸气带出,使Br2(g)?Br2(aq)或Br2+H2O?HBr+HBrO平衡向左移动;
②从MgCl2溶液中得到MgCl2固体,操作是加热浓缩蒸发、冷却结晶、过滤洗涤、干燥得到无水氯化镁,电解熔融氯化镁得到金属镁和氯气,
故答案为:蒸发浓缩、冷却结晶;
③若将10m3海水中的溴元素转化为工业溴,依据图表中溴元素含量为64mg/L,10m3海水中含溴元素=10×1000L×64g/L×10-3=640g;物质的量=$\frac{640g}{80g/mol}$=8mol,依据反应计算得到:2Br-+Cl2=Br2+2Cl-,消耗氯气物质的量为:4mol;提取过程中需要两次通入氯气实现溴离子被氧化,所以至少需要标准状况下Cl2的物质的量为8 mol标准状况下体积为 8mol×22.4L/mol=179.2L,
故答案为:179.2.
点评 本题考查了海水淡化的电渗析原理的分析判断,海水中溴的提取过程,溶液中得到固体的条件应用,反应过程中的氧化剂计算,注意氯气两次氧化消耗,题目难度中等.

| A. | 达到化学平衡时,5v正(O2)=4v逆(NO) | |
| B. | 若单位时间内生成nmol NO的同时,生成nmol NH3,则反应达到平衡状态 | |
| C. | 达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 | |
| D. | 化学反应速率关系是:2v正(NH3)=3v正(H2O) |
| A. | 离子的数目相等 | B. | 粒子的总的物质的量相等 | ||
| C. | 正电荷总数和负电荷总数应相等 | D. | 反应前后原子的数目不一定相等 |
| A. | H2与D2、T2互为同位素 | |
| B. | 氯化钠溶液和氢氧化铁胶体可以用过滤的方法分离 | |
| C. | NH3溶于水可以导电,但不是电解质 | |
| D. | SO2、NO2均属于酸性氧化物 |
| A. | NaOH | B. | CaO | C. | Na2CO3 | D. | FeSO4 |
| 成分 | 质量(g) | 摩尔质量(g•mol-1) |
| 蔗糖 | 50.0 | 342 |
| 硫酸钾 | 0.5 | 174 |
| 阿司匹林 | 0.4 | 180 |
| 高锰酸钾 | 0.5 | 158 |
| 硝酸银 | 0.2 | 170 |
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸银
(2)“营养液”中K+(阿司匹林中不含K+)的物质的量浓度为$\frac{\frac{0.5}{158}+\frac{0.5}{174}×2}{0.5}$ mol•L-1(只要求写表达式,不用写出计算结果).
(3)配制上述“营养液”500mL所需的仪器有:电子天平、药匙、烧杯、500ml容量瓶、玻璃棒、胶头滴管.(在横线上填写所缺仪器的名称)
(4)在配制一定物质的量浓度的溶液时,一般可分为以下几个步骤:①称量②计算③溶解
④摇匀⑤转移⑥洗涤⑦定容⑧冷却.其正确的操作顺序为②①③⑧⑤⑥⑦④.
(5)在溶液配制过程中,下列操作对配制结果没有影响的是BC,使所配制溶液的浓度偏高的是A,偏低的是DE.
A.定容时俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
D.转移溶液后,未洗涤烧杯和玻璃棒就直接定容
E.定容时发现液面高于容量瓶的刻度线,倒出一部分液体后再加蒸馏水至刻度线.
 2015年10月5日诺贝尔医学奖授予中国女药学家屠呦呦及美国科学家威廉•坎贝尔和日本大村智,以表彰他们在寄生虫疾病治疗方面取得的成就.屠呦呦1971年发现、分离、提纯并用于治疟新药“青蒿素”,拯救了数千万人的生命.青蒿素分子结构如图.下列说法错误的是( )
2015年10月5日诺贝尔医学奖授予中国女药学家屠呦呦及美国科学家威廉•坎贝尔和日本大村智,以表彰他们在寄生虫疾病治疗方面取得的成就.屠呦呦1971年发现、分离、提纯并用于治疟新药“青蒿素”,拯救了数千万人的生命.青蒿素分子结构如图.下列说法错误的是( )| A. | 青蒿素的分子式为C15H22O5 | B. | 青蒿素是芳香族化合物 | ||
| C. | 青蒿素可以发生水解反应 | D. | 青蒿素不能使酸性KMnO4溶液褪色 |
 、
、 、
、 烯烃的名称:
烯烃的名称: