题目内容
8.(1)黑火药是中国古代的四大发明之一,其爆炸的原理为:S+2KNO3+3C═K2S+N2+3CO2,已知碳的燃烧热△H1=a kJ•mol-1;S(s)+2K(s)═K2S(s)△H2=b kJ•mol?1;2K(s)+N2(g)+3O2(g)═2KNO3(s)△H3=c kJ•mol?1;写出黑火药爆炸的热化学方程式:S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g)△H=(3a+b-c)kJ/mol.
(2)已知:P4(s)+6Cl2(g)=4PCl3(g)△H=akJ•mol-1;P4(s)+10Cl2(g)=4PCl5(g)△H=bkJ•mol-1;P4具有正四面体结构,PCl5中P-Cl键的键能为ckJ•mol-1,PCl3中P-Cl键的键能为1.2ckJ•mol-1,则Cl-Cl键的键能为1.4c+0.25b-0.25a.
(3)已知碘与氢气反应的热化学方程式是:①I2(g)+H2(g)?2HI(g)△H=-9.48kJ•mol-1;②I2(s)+H2(g)?2HI(g)△H=+26.48kJ•mol-1;则1mol固态碘转化为气态碘需要吸收(填“吸收”或“放出”)能量35.96kJ/mol.
(4)已知4Al(s)+3O2(g)=2Al2O3(s)△H1;4Fe(s)+3O2(g)=2Fe2O3(s)△H2,则△H1<△H 2(填“>”、“<”或“无法确定”)
分析 (1)碳的燃烧热△H1=a kJ•mol-1,其热化学方程式为C(s)+O2(g)=CO2(g)△H1=a kJ•mol-1①
S(s)+2K(s)═K2S(s)△H2=b kJ•mol-1②
2K(s)+N2(g)+3O2(g)═2KNO3(s)△H3=c kJ•mol-1③
将方程式3①+②-③得S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g),其反应热进行相应的改变,据此计算反应热;
(2)依据盖斯定律和已知热化学方程式求出Cl2(g)+PCl3(g)=PCl5(g)的反应热,再依据焓变=反应物键能之和-生成物键能之和计算分析;
(3)已知:①I2(g)+H2(g)?2HI(g)△H=-9.48kJ•mol-1;②I2(s)+H2(g)?2HI(g)△H=+26.48kJ•mol-1,利用盖斯定律将①-②可得I2(g)=I2(s)△H=-9.48kJ•mol-1-26.48kJ•mol-1=-35.96kJ•mol-1;
(4)根据盖斯定律利用铝热反应为放热反应来判断.
解答 解:(1)碳的燃烧热△H1=a kJ•mol-1,其热化学方程式为C(s)+O2(g)=CO2(g)△H1=a kJ•mol-1①
S(s)+2K(s)═K2S(s)△H2=b kJ•mol-1②
2K(s)+N2(g)+3O2(g)═2KNO3(s)△H3=c kJ•mol-1③
将方程式3①+②-③得S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g),则△H=x kJ•mol-1=(3a+b-c)kJ•mol-1,所以x=3a+b-c,
故答案为:S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g)△H=(3a+b-c)kJ/mol;
(2)已知:①P4(g)+6Cl2(g)=4PCl3(g)△H=a kJ?mol-1;
②P4(g)+10Cl2(g)=4PCl5(g)△H=b kJ?mol-1;
利用“盖斯定律”,(②-①)×$\frac{1}{4}$得:Cl2(g)+PCl3(g)=PCl5(g)△H=$\frac{b-a}{4}$KJ•mol-1,
由Cl2(g)+PCl3(g)=PCl5(g)△H=$\frac{b-a}{4}$KJ•mol-1 可得E(Cl-Cl)+3×1.2c-5c=$\frac{b-a}{4}$,
因此可得:E(Cl-Cl)=$\frac{b-a+5.6c}{4}$kJ•mol-1=1.4c+0.25b-0.25akJ•mol-1;
故答案为:1.4c+0.25b-0.25a;
(3)已知:①I2(g)+H2(g)?2HI(g)△H=-9.48kJ•mol-1;②I2(s)+H2(g)?2HI(g)△H=+26.48kJ•mol-1,利用盖斯定律将①-②可得I2(g)=I2(s)△H=-9.48kJ•mol-1-26.48kJ•mol-1=-35.96kJ•mol-1,所以1mol固态碘转化为气态碘需吸收35.96kJ的能量;
故答案为:吸收;35.96;
(4)4Al(s)+3O2(g)═2Al2O3(s)△H1 ①
4Fe(s)+3O2(g)═2Fe2O3(s)△H2 ②
由盖斯定律①-②,得:4Al(s)+2Fe2O3═2Al2O3(s)+4Fe(s)△H1 -△H2,
铝热反应为放热反应,即△H1 -△H2<0,所以△H1<△H2,
故答案为:<.
点评 本题考查盖斯定律的应用,侧重考查学生分析计算能力,明确目标方程式与已知方程式的关系是解本题关键,注意方程式可以进行加减,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | Al | B. | Mg | ||
| C. | Na | D. | 三者产生的氢气一样多 |
| A. | 131I是一种新发现的元素 | |
| B. | 我们平常食用的加碘盐就是含有碘单质的食盐 | |
| C. | 卤素F、Cl、Br、I中,I的电负性和第一电离能都最小 | |
| D. | 碘单质易升华是由于碘原子半径大,共价键键能小 |
| A. | 若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀 | |
| B. | 一定条件下反应N2+3H22?NH3达到平衡时,3v正(H2)=2v逆(NH3) | |
| C. | 酸碱质子理论认为,凡能给出质子(H+) 的物质都是酸,凡能接受质子的物质都是碱.根据这一理论,Al(OH)3、NaHCO3都是两性物质 | |
| D. | 对于乙酸与乙醇的酯化反应(△H<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大 |
| A. | KOH溶液与AlCl3溶液 | B. | NaAlO2溶液与盐酸 | ||
| C. | NaHCO3溶液与盐酸 | D. | Na2CO3溶液与盐酸 |
 汽化 ②将胆矾加热变为白色粉末
汽化 ②将胆矾加热变为白色粉末 2CO
2CO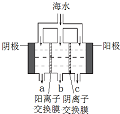 海洋是丰富的资源宝库,通过海水的综合利用可获得许多物质供人类使用.
海洋是丰富的资源宝库,通过海水的综合利用可获得许多物质供人类使用.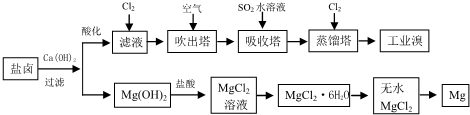
 某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.
某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.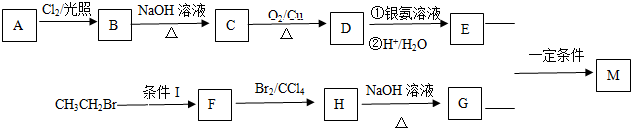
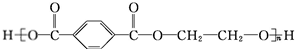 .
.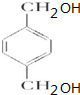 +O2$→_{△}^{Cu}$
+O2$→_{△}^{Cu}$ +2H2O.
+2H2O.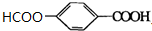 (写出所有可能的结构简式)
(写出所有可能的结构简式)