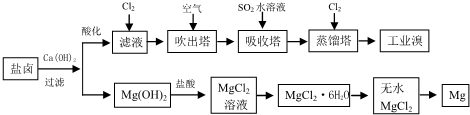
题目内容
9.对可逆反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g),则下列叙述中正确的是( )| A. | 达到化学平衡时,5v正(O2)=4v逆(NO) | |
| B. | 若单位时间内生成nmol NO的同时,生成nmol NH3,则反应达到平衡状态 | |
| C. | 达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 | |
| D. | 化学反应速率关系是:2v正(NH3)=3v正(H2O) |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、不同物质表示正逆反应速率之比等于化学计量数之比,4v正(O2)=5v逆(NO),表示反应达到平衡状态,故A错误;
B、若单位时间内生成nmolNO等效于消耗nmolNH3,的同时生成nmol NH3,正逆反应速率相等,说明到达平衡,故B正确;
C、达到化学平衡时,若增加容器体积,则反应混合物的浓度减小,正、逆反应速率均减小,平衡向正反应移动,故C错误;
D、反应处于平衡状态时,不同物质表示正逆反应速率之比等于化学计量数之比,应为3v正(NH3)=2v逆(H2O),则2v正(NH3)=3v正(H2O)未到达平衡状态,故D错误;
故选B.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
20.某化妆品的组分Z具有美白功效,原来是从杨树中提取,现在可用如下反应制备:
下列叙述不正确的是( )

下列叙述不正确的是( )
| A. | X、Y和Z均能使溴水褪色 | |
| B. | Y既能发生取代反应,也能发生加成反应 | |
| C. | X和Z均能与NaHCO3溶液反应放出CO2 | |
| D. | Y可作加聚反应单体,X可作缩聚反应单体 |
4.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,16g O2和32g O3的混合物中,含有O原子数月为3NA | |
| B. | 标准状况下,1mol Na2O和1mol Na2O2的混合物中,含有离子总数为7NA | |
| C. | 1 mol NaBH4中离子键的数目为2NA | |
| D. | 在K${\;}_{\;}^{35}$ClO3+6H${\;}_{\;}^{37}$Cl═KCl+3Cl2↑+3H2O中,若生成71 g Cl2,转移的电子数目为$\frac{5}{3}$NA |
14.Na、Mg、Al 三种金属各 2mol 分别跟足量的盐酸反应时,相同条件下放出氢气体积最大的是( )
| A. | Al | B. | Mg | ||
| C. | Na | D. | 三者产生的氢气一样多 |


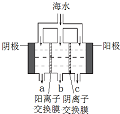 海洋是丰富的资源宝库,通过海水的综合利用可获得许多物质供人类使用.
海洋是丰富的资源宝库,通过海水的综合利用可获得许多物质供人类使用.