题目内容
尿素[CO(NH2)2]是首个由无机物人工合成的有机物.工业上合成尿素的反应如下:
2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O (l)△H<0.回答下列问题:
(1)已知工业上合成尿素分两步进行,相关反应如下:
反应Ⅰ:2NH3(g)+CO2(g)?NH2COONH4(s)△H1<0
反应Ⅱ:NH2COONH4(s)?CO(NH2)2(l)+H2O (l)△H 2>0
下列示意图中[a表示2NH3(g)+CO2(g),b表示NH3COONH4(s),c表示CO(NH2)2(l)+H2O(l)],能正确表示尿素合成过程中能量变化曲线是(填序号) .
(2)某实验小组模拟工业上合成尿素的条件,在恒定温度下,将氨气和二氧化碳按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质浓度的变化曲线如图(1)所示
①在上述条件下,从反应开始至20min时,二氧化碳的平均反应速率为 .
②为提高尿素的产率,下列可以采取的措施有 .
A.缩小反应器的容积
B.升高温度
C.平衡体系中及时分离出少量CO(NH2)2
D使用合适的催化剂
③该反应的平衡常数表达式K=
若升高体系的温度,容器中NH3的体积分数将 (填“增加”、“减小”、“不变”).
④若保持平衡的温度和体积不变,25min时再向容器中充入2mol氨气和1mol二氧化碳,在40min时重新达到平衡,请在图(2)中画出25~50min内氨气的浓度变化曲线.
2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O (l)△H<0.回答下列问题:
(1)已知工业上合成尿素分两步进行,相关反应如下:
反应Ⅰ:2NH3(g)+CO2(g)?NH2COONH4(s)△H1<0
反应Ⅱ:NH2COONH4(s)?CO(NH2)2(l)+H2O (l)△H 2>0
下列示意图中[a表示2NH3(g)+CO2(g),b表示NH3COONH4(s),c表示CO(NH2)2(l)+H2O(l)],能正确表示尿素合成过程中能量变化曲线是(填序号)
(2)某实验小组模拟工业上合成尿素的条件,在恒定温度下,将氨气和二氧化碳按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质浓度的变化曲线如图(1)所示

①在上述条件下,从反应开始至20min时,二氧化碳的平均反应速率为
②为提高尿素的产率,下列可以采取的措施有
A.缩小反应器的容积
B.升高温度
C.平衡体系中及时分离出少量CO(NH2)2
D使用合适的催化剂
③该反应的平衡常数表达式K=
若升高体系的温度,容器中NH3的体积分数将
④若保持平衡的温度和体积不变,25min时再向容器中充入2mol氨气和1mol二氧化碳,在40min时重新达到平衡,请在图(2)中画出25~50min内氨气的浓度变化曲线.
考点:反应热和焓变,反应速率的定量表示方法,化学平衡的影响因素
专题:化学平衡专题
分析:(1)根据反应物和生成物的能量高低与反应吸放热之间的关系来判断;
(2)①根据化学反应速率等于单位时间内物质浓度的变化量来计算;
②根据影响化学平衡移动的因素来回答判断;
③化学平衡常数表达式=
来书写;升高温度,化学平衡向着吸热方向进行;
④根据等效平衡知识来作图.
(2)①根据化学反应速率等于单位时间内物质浓度的变化量来计算;
②根据影响化学平衡移动的因素来回答判断;
③化学平衡常数表达式=
| 生成物平衡浓度系数次幂的乘积 |
| 反应物平衡浓度系数次幂的乘积 |
④根据等效平衡知识来作图.
解答:
解:(1)当反应物的能量高于生成物的能量时,反应是放热反应,当反应物的能量低于生成物的能量时,反应是吸热反应,据反应Ⅰ:2NH3(g)+CO2(g)?NH2COONH4(s)△H1<0,
反应Ⅱ:NH2COONH4(s)?CO(NH2)2(I)+H2O(I)△H2>0,可以知道2NH3(g)和CO2(g)的能量和高于NH2COONH4(s)的能量,NH2COONH4(s)的能量低于CO(NH2)2(I)+H2O(I)的能量,故C正确;
故答案为:C;
(2)①从反应开始至20min时,二氧化碳的平均反应速率=
=0.01mol/(L?min),故答案为:0.01mol/(L?min);
②为提高尿素的产率,可以是化学平衡向着正反应方向进行,
A.缩小反应容器的容积,即增大压强,化学平衡正向移动,故A正确;
B.升高温度,化学平衡2NH3(g)+CO2(g)?NH2COONH4(s)△H1<0逆向移动,故B错误;
C.CO(NH2)2为固体,改变其物质的量浓度不变,对平衡无响应,所以及时分离出CO(NH2)2不能增大产率,故C错误;
D.使用合适的催化剂,不会引起平衡的移动,故D错误
故选A;
③反应中只有NH3(g)和CO2为气体,其它均为固体或液态,则该反应的平衡常数表达式K=
,反应的产物是液态,只有反应物是气态,若升高体系的温度,容器中NH3的体积分数不会改变,
故答案为:
;不变;
④25min时再向容器中充入2mol氨气和1mol二氧化碳,在40min时重新达到平衡,则建立的是等效平衡,氨气的平衡浓度保持不变,曲线如下: ,
,
故答案为: .
.
反应Ⅱ:NH2COONH4(s)?CO(NH2)2(I)+H2O(I)△H2>0,可以知道2NH3(g)和CO2(g)的能量和高于NH2COONH4(s)的能量,NH2COONH4(s)的能量低于CO(NH2)2(I)+H2O(I)的能量,故C正确;
故答案为:C;
(2)①从反应开始至20min时,二氧化碳的平均反应速率=
| 0.3mol/L-0.1mol/L |
| 20min |
②为提高尿素的产率,可以是化学平衡向着正反应方向进行,
A.缩小反应容器的容积,即增大压强,化学平衡正向移动,故A正确;
B.升高温度,化学平衡2NH3(g)+CO2(g)?NH2COONH4(s)△H1<0逆向移动,故B错误;
C.CO(NH2)2为固体,改变其物质的量浓度不变,对平衡无响应,所以及时分离出CO(NH2)2不能增大产率,故C错误;
D.使用合适的催化剂,不会引起平衡的移动,故D错误
故选A;
③反应中只有NH3(g)和CO2为气体,其它均为固体或液态,则该反应的平衡常数表达式K=
| 1 |
| c(NH3)?c(CO2)2 |
故答案为:
| 1 |
| c(NH3)?c(CO2)2 |
④25min时再向容器中充入2mol氨气和1mol二氧化碳,在40min时重新达到平衡,则建立的是等效平衡,氨气的平衡浓度保持不变,曲线如下:
 ,
,故答案为:
 .
.
点评:本题是一道关于化学反应能量变化,化学反应速率和化学平衡移动的总合考查题,主要考查了化学平衡移动原理应用,平衡常数计算,考查学生分析和解决问题的能力,难度中等.

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案
相关题目
常温下,下列各组离子在指定的溶液中可能大量共存的是( )
| A、加入过氧化钠后的溶液中:Na+、K+、Cl-、SO32- |
| B、含大量Fe3+的溶液中:Mg2+、Cl-、SO42-、NO3- |
| C、与Al反应放出H2的溶液中:NH4+、Na+、SO42-、F- |
| D、无色透明溶液中:Al3+、Ca2+、I-、HCO3- |
室温下,水的电离达到平衡:H2O?H++OH-.下列叙述正确的是( )
| A、将水加热,平衡向正反应方向移动,KW不变 |
| B、向水中加入少量盐酸,平衡向正反应方向移动,c(H+)增大 |
| C、向水中加入少量NaOH固体,平衡向逆反应方向移动,c(OH-)降低 |
| D、向水中加少量CH3COONa固体,平衡向正反应方向移动,水电离出c(OH-)和 c(H+)相等 |
下列事实不能用勒夏特利原理来解释的是( )
| A、用排饱和食盐水的方法收集氯气 |
| B、合成氨工业选择高温 |
| C、增大压强,有利于SO2和O2反应生成SO3 |
| D、在Fe3++3SCN -?Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深 |
下列烷烃中,沸点最高的是( )
| A、2-甲基丙烷 |
| B、2,2-二甲基丙烷 |
| C、正己烷 |
| D、2-甲基戊烷 |

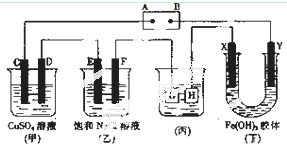 如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向乙中滴入酚酞液,在F极附近显红色.
如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向乙中滴入酚酞液,在F极附近显红色.