题目内容
(1)在同温同压下,同体积的甲烷(CH4)和二氧化碳分子数之比为 ,物质的量之比为 ,原子总数之比为 ;质量之比为
(2)若某原子的摩尔质量是Mg/mol,则一个该原子的真实质量是 g.
(3)0.2molH3O+所含原子为 mol,电子数为 ,质子数为 .
(4)标准状况下,①4g氢气、②33.6L甲烷、③6.02×1023个水分子中,含分子数最多的是(填序号,下同) ,含原子数最多的是 ,体积最小的是 .
(2)若某原子的摩尔质量是Mg/mol,则一个该原子的真实质量是
(3)0.2molH3O+所含原子为
(4)标准状况下,①4g氢气、②33.6L甲烷、③6.02×1023个水分子中,含分子数最多的是(填序号,下同)
考点:物质的量的相关计算
专题:计算题
分析:(1)同温同压下,相同体积的气体物质的量相同,根据物质的量和分子组成计算原子个数关系,根据物质的量和气体的摩尔质量计算质量的关系;
(2)根据1mol任何微粒的数目均为NA个,结合阿伏加德罗常数的含义来计算;
(3)H3O+中含有4个原子,10个电子11个质子;
(4)根据物质的量与摩尔质量、质量的关系,气体摩尔体积的计算和微粒数与物质的量、阿伏伽德罗常熟的关系进行计算.
(2)根据1mol任何微粒的数目均为NA个,结合阿伏加德罗常数的含义来计算;
(3)H3O+中含有4个原子,10个电子11个质子;
(4)根据物质的量与摩尔质量、质量的关系,气体摩尔体积的计算和微粒数与物质的量、阿伏伽德罗常熟的关系进行计算.
解答:
解:(1)同温同压下,相同体积的气体物质的量相同,分子数目相同,则物质的量之比为1:1,分子数之比为1:1,
甲烷的分子式为CH4,1个分子中含有5个原子,二氧化碳的分子式为CO2,1个分子中含有3个原子,相同物质的量的气体原子数之比为5:3,
甲烷的相对分子质量为16,二氧化碳的相对分子质量为44,则质量之比为16:44=4:11,
故答案为:1:1;1:1;5:3;4:11;
(2)根据摩尔质量知,1mol该原子的质量是Mg,1mol原子有阿伏加德罗常数NA个,即NA个原子的质量是M g,则一个该原子的真实质量约为
g,
故答案为:
;
(3)一个H3O+中含有4个原子,10个电子11个质子,则0.2molH3O+所含原子为0.8mol,电子数为2NA,质子数为2.2NA;
故答案为:0.8;2NA;2.2NA;
(4)氢气的物质的量为2mol,氢气分子数为2NA,氢原子数为4NA,标准状况下的体积为44.8L;
甲烷的物质的量为1.5mol,分子数为1.5NA,原子数为1.5NA×5=7.5NA,标准状况下的体积为33.6L;
水的物质的量为1mol,质量为18g,分子数为1NA,原子数为1NA×3=3NA,水常温下是非气体,其体积约为18mL.
综上分析,可知:含分子数最多的是①,含原子数最多的是②,体积最小的是③.
故答案为:①;②;③.
甲烷的分子式为CH4,1个分子中含有5个原子,二氧化碳的分子式为CO2,1个分子中含有3个原子,相同物质的量的气体原子数之比为5:3,
甲烷的相对分子质量为16,二氧化碳的相对分子质量为44,则质量之比为16:44=4:11,
故答案为:1:1;1:1;5:3;4:11;
(2)根据摩尔质量知,1mol该原子的质量是Mg,1mol原子有阿伏加德罗常数NA个,即NA个原子的质量是M g,则一个该原子的真实质量约为
| M |
| NA |
故答案为:
| M |
| NA |
(3)一个H3O+中含有4个原子,10个电子11个质子,则0.2molH3O+所含原子为0.8mol,电子数为2NA,质子数为2.2NA;
故答案为:0.8;2NA;2.2NA;
(4)氢气的物质的量为2mol,氢气分子数为2NA,氢原子数为4NA,标准状况下的体积为44.8L;
甲烷的物质的量为1.5mol,分子数为1.5NA,原子数为1.5NA×5=7.5NA,标准状况下的体积为33.6L;
水的物质的量为1mol,质量为18g,分子数为1NA,原子数为1NA×3=3NA,水常温下是非气体,其体积约为18mL.
综上分析,可知:含分子数最多的是①,含原子数最多的是②,体积最小的是③.
故答案为:①;②;③.
点评:本题考查物质的量的有关计算,以及阿伏伽德罗定律及推论,题目难度不大,注意把握物质的量、质量、体积之间的计算公式的运用.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:
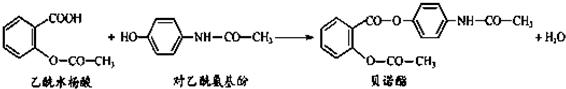
下列有关叙述正确的是( )

下列有关叙述正确的是( )
| A、贝诺酯分子中有三种含氧官能团 |
| B、对乙酰氨基酚核磁共振氢谱中共有四个峰 |
| C、乙酰水杨酸和对乙酰氨基酚均能与Na2CO3 溶液反应 |
| D、贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠 |
下列说法中正确的是( )
| A、胶体带电荷,而溶液呈电中性 |
| B、胶体区别与其他分散系的本质特征是分散质粒子的大小 |
| C、某元素从化合态变为游离态时,该元素一定被还原 |
| D、醋酸、纯碱、石灰石、氨水分别属于酸、碱、盐和电解质 |
常温下,在溶液中可发生以下反应:①16H++10Z-+2XO4-═2X2++5Z2+8H2O,②2M2++R2═2M3++2R-,③2R-+Z2═R2+2Z-,由此判断下列说法错误的是( )
| A、常温下反应2M2++Z2═2M3++2Z-可以自发进行 |
| B、Z元素在反应①中被氧化,在③中被还原 |
| C、氧化性强弱顺序为:XO4-<Z2<R2<M3+ |
| D、还原性强弱顺序为:X2+<Z-<R-<M2+ |
 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: