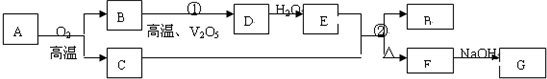
题目内容
(1)1g硫粉在氧气中充分燃烧放出9.36kJ热量,写出1mol硫燃烧的热化学方程式
(2)热化学方程式:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol H2O(l)=H2(g)+
O2(g)△H= .
(2)热化学方程式:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol H2O(l)=H2(g)+
| 1 |
| 2 |
考点:热化学方程式
专题:化学反应中的能量变化
分析:(1)热化学方程式的书写,需要注意的有:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比;
(2)依据热化学方程式书写原则分析,热化学方程式同时改变计量数,焓变也同时改变,热化学方程式改变方向,焓变改变符号;
(2)依据热化学方程式书写原则分析,热化学方程式同时改变计量数,焓变也同时改变,热化学方程式改变方向,焓变改变符号;
解答:
解:(1)1g硫粉完全燃烧生成二氧化硫气体,放出9.36kJ的热量,所以32g硫粉完全燃烧生成二氧化硫气体,放出299.52kJ的热量,则热化学方程式为:S(s)+O2(g)═SO2(g),△H=-290.52kJ/mol,
故答案为:S(s)+O2(g)═SO2(g),△H=-299.52kJ/mol;
(2)热化学方程式同时改变计量数,焓变也同时改变,热化学方程式改变方向,焓变改变符号,热化学方程式:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol H2O(l)=H2(g)+
O2(g)△H=
=+285.8KJ/mol;
故答案为:+285.8KJ/mol;
故答案为:S(s)+O2(g)═SO2(g),△H=-299.52kJ/mol;
(2)热化学方程式同时改变计量数,焓变也同时改变,热化学方程式改变方向,焓变改变符号,热化学方程式:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol H2O(l)=H2(g)+
| 1 |
| 2 |
| 571.6KJ/mol |
| 2 |
故答案为:+285.8KJ/mol;
点评:本题考查了热化学方程式的书写,难度不大,注意掌握热化学方程式的书写规则.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
对于相同质量的SO2和SO3,下列说法中正确的是( )
| A、硫元素的质量比为1:1 |
| B、氧元素的质量比为6:5 |
| C、电子总数之比为1:1 |
| D、物质的量之比为4:5 |
下列离子方程式书写正确的是( )
| A、氯化铁溶液腐蚀铜制作印刷电路板:2Fe3++Cu=2Fe2++Cu2+ |
| B、漂白粉溶液中通入SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
| C、向碘化钾溶液中通入臭氧:O3+2I一+3H2O═6OH-+I2 |
| D、向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
下列不属于取代反应的是( )
A、CH4+Cl2
| |||
B、CH3Cl+Cl2
| |||
C、CH3OH+HCl
| |||
D、CH2=CH2+H2
|
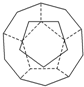 德国和美国科学家首先制出由20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成如图.
德国和美国科学家首先制出由20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成如图.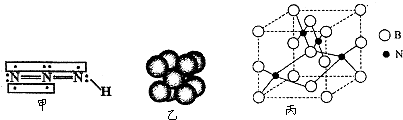
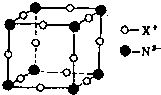 氮元素是重要的非金属元素,可形成卤化物、氮化物,叠氮化物及配合物等多种化合物.
氮元素是重要的非金属元素,可形成卤化物、氮化物,叠氮化物及配合物等多种化合物.