题目内容
8.下列各选项有机物数目,与分子式为ClC4H7O2 且能与碳酸氢钠反应生成气体的有机物数目相同的是(不含立体异构)( )| A. | 分子式为C5H10 的烯烃 | B. | 分子式为C4H8O2的酯 | ||
| C. | 甲苯( 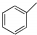 )的一氯代物 )的一氯代物 | D. | 立体烷 (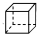 )的二氯代物 )的二氯代物 |
分析 分子式为ClC4H7O2 且能与碳酸氢钠反应生成气体,说明含有羧基,然后看成溴原子取代丁酸烃基上的氢原子,丁酸有2种:CH3CH2CH2COOH、(CH3)2CHCOOH,所以该有机物有3+2=5种;
A.分子式为C5H10 的烯烃,说明含有1个C=C双键,根据碳链缩短法书写同分异构体;
B.分子式为C4H8O2的酯,为饱和一元酯,根据酸和醇的种类来确定;
C.根据一氯代物的种类等于氢原子的种类;
D.烃的二氯代物的同分异构体可以采用固定一个氯原子的方法.
解答 解:分子式为ClC4H7O2 且能与碳酸氢钠反应生成气体,说明含有羧基,然后看成溴原子取代丁酸烃基上的氢原子,丁酸有2种:CH3CH2CH2COOH、(CH3)2CHCOOH,所以该有机物有3+2=5种;
A.戊烷的同分异构体有:CH3-CH2-CH2-CH2-CH3、 、
、 ,若为CH3-CH2-CH2-CH2-CH3,相应烯烃有CH2═CH-CH2-CH2-CH3、CH3-CH═CH-CH2-CH3;若为
,若为CH3-CH2-CH2-CH2-CH3,相应烯烃有CH2═CH-CH2-CH2-CH3、CH3-CH═CH-CH2-CH3;若为 ,相应烯烃有:CH2═C(CH3)CH2CH3;CH3C(CH3)═CHCH3;CH3CH(CH3)CH═CH2;若为
,相应烯烃有:CH2═C(CH3)CH2CH3;CH3C(CH3)═CHCH3;CH3CH(CH3)CH═CH2;若为 ,没有相应烯烃,总共5种,故A正确;
,没有相应烯烃,总共5种,故A正确;
B.分子式为C4H8O2的酯,为饱和一元酯,若为甲酸与丙醇形成的酯,甲酸只有1种结构,丙醇有2种,形成的酯有2种;若为乙酸与乙醇形成的酯,乙酸只有1种结构,乙醇只有1种结构,形成的乙酸乙酯有1种;若为丙酸与甲醇形成的酯,丙酸只有1种结构,甲醇只有1种结构,形成的丙酸甲酯只有1种,所以C4H8O2属于酯类的同分异构体共有4种,故B错误;
C.甲苯分子中含有4种氢原子,一氯代物有4种:苯环上邻、间、对位各一种,甲基上一种,故C错误;
D.立方烷的二氯代物的同分异构体分别是:一条棱、面对角线、体对角线上的两个氢原子被氯原子代替,所以二氯代物的同分异构体有4种,故D错误;
故选A.
点评 本题考查学生对同分异构体的理解,注意方法的总结与运用是解题的关键,难度不大.

| A. | 四氯化碳分子的比例模型: | |
| B. | 羟基可以表示为:-OH 或 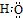 | |
| C. | 氯离子(Cl-)的结构示意图: | |
| D. | NaHSO4熔融时的电离方程式:NaHSO4=Na++H++SO42- |
| A | B | C |
| D |
| A. | C的非金属性最强,可分别与A、E元素形成离子化合物 | |
| B. | 元素D可形成三种常见的酸,且酸根离子均能促进水的电离 | |
| C. | C单质可以从D、E组成的化合物的水溶液中置换出D | |
| D. | 离子半径由大到小的顺序为:D>E>A>B>C |
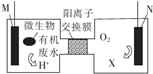 为解决淀粉厂沸水中BOD严重超标的问题,有人设计了电化学降解法,如图是利用一种微生物将废水中有机物[主要成分是(C6H10O5)n]的化学能转化为电能的装置,下列说法中正确的是( )
为解决淀粉厂沸水中BOD严重超标的问题,有人设计了电化学降解法,如图是利用一种微生物将废水中有机物[主要成分是(C6H10O5)n]的化学能转化为电能的装置,下列说法中正确的是( )| A. | N极是负极 | |
| B. | 负极的电极反应为(C6H10O5)n]+7nH2O-24ne-═6nCO2↑+24nH+ | |
| C. | 物质X是OH- | |
| D. | 该装置工作时,H+从右侧经阳离子交换膜转向左侧 |
| A. | 1molNa与O2反应得到32g固体产物,钠失去电子数为NA | |
| B. | 用1mL0.1mol•L-1FeCl3溶液制得的氢氧化铁胶体所含胶粒数为10-4NA | |
| C. | 12g金刚石中含有的共价键数为2NA | |
| D. | 标准状况下,22.4LCH4中含有的碳原子数为NA |
| A. | 将1molCl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2NA | |
| B. | 100mL 18.4mo1•L-1硫酸与足量Cu反应,生成SO2的分子数为0.92NA | |
| C. | 标准状况下,2.24 L三氯甲烷中含有碳氯共价键的数目为0.3NA | |
| D. | 用惰性电极电解CuSO4溶液一段时间后,若加入0.05mol的Cu2(OH)2CO3固体恰好能使溶液恢复到原来的浓度,则该电解过程中转移电子的数目为0.3NA |
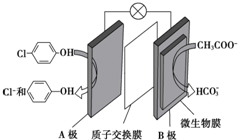 含乙酸钠和对氯酚(
含乙酸钠和对氯酚(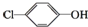 )的废水可以利用微生物电池除去,其原理如图所示,下列有关说法不正确的是( )
)的废水可以利用微生物电池除去,其原理如图所示,下列有关说法不正确的是( )| A. | 电极B是负极 | |
| B. | 质子从A极移向B极 | |
| C. | B极的电极反应式:CH3COO--8e-+4H2O═2HCO3-+9H+ | |
| D. | 处理后的废水pH降低 |
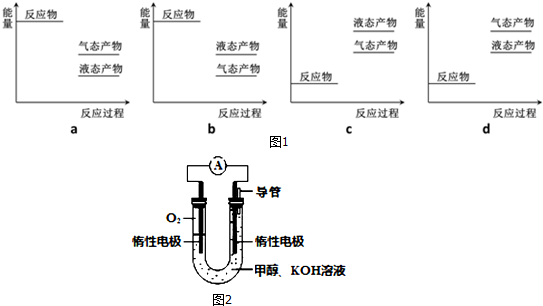
(1)已知,CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.5kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ•mol-1
则如图1表示工业上以CO2(g)、H2(g)为原料合成该甲醇反应的能量变化示意图中正确的是a(填字母代号).
(2)CO和H2反应也能合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-90.1kJ•mol-1.在250℃下,将一定量的CO和H2投入10L的恒容密闭容器中,各物质的浓度(mol•L-1)变化如下表所示(前6min没有改变条件):
| 2min | 4min | 6min | 8min | … | |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.2 | … |
| CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | … |
②若6~8min时只改变了一个条件,则改变的条件是充入一定量H2,第8min时,该反应是否达到平衡状态?不是(填“是”或“不是”).
③若容器容积不变,下列措施可增加甲醇产率的是BD(填序号).
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入1mol CO和3mol H2
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.
①该电池负极的电极反应为CH3OH-6e-+8OH-=CO32-+6H2O;
②该电池工作时,溶液中的OH-向负极移动.
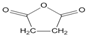 ),试剂③是环氧乙烷(
),试剂③是环氧乙烷(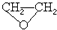 ),且环氧乙烷在酸或碱中易水解或聚合.
),且环氧乙烷在酸或碱中易水解或聚合.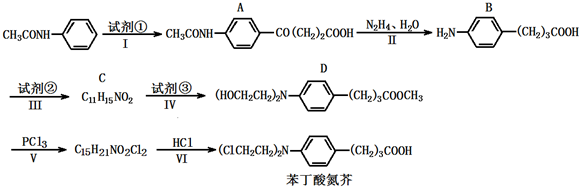
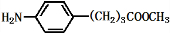
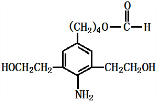
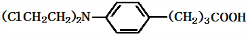 +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$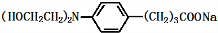 +2NaCl+H2O
+2NaCl+H2O