题目内容
6.以铝土矿(主要成分是Al2O3,杂质有SiO2、Fe2O3等)为原料,采用拜耳法生产Al2O3的流程如图1所示: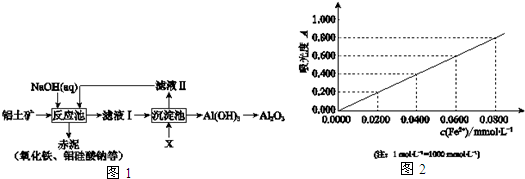
(1)Al2O3可用于电解制Al,其反应的化学方程式是2Al2O3(熔融)═4Al+3O2↑.
(2)调控反应池中钠铝元素之比一定时,Al2O3溶于NaOH,SiO2转化为铝硅酸钠沉淀.Al2O3溶于NaOH的离子方程式是Al2O3+2OH-=2AlO2-+H2O.
(3)该生产过程中,需向沉淀池中加入X.
①X 可为过量的CO2,则滤液II中主要的溶质是NaHCO3,为了使滤液II循环利用,应补充的物质是a(选填字母);
a.CaO b.HCl c.Na2CO3
②X 也可为少量Al(OH)3晶种(晶种可加速沉淀的生成),其优点是滤液 II可直接循环使用.
(4)测铝土矿中铝元素含量:
I 将m g铝土矿样品经处理配成V mL溶液
II 取少量该溶液用EDTA法测得该溶液中Fe3+、Al3+浓度之和为a mol•L-1
III 另取少量该溶液,将Fe3+用盐酸羟胺还原为Fe2+后,利用吸光度法测得吸光度为0.400(吸光度与Fe2+浓度对应曲线如图2),该铝土矿样品中铝元素的质量分数表达式是$\frac{27V(a-0.0400×10{\;}^{-3})}{1000m}$(用字母表示).
分析 铝土矿中加入氢氧化钠溶液,氧化铝和二氧化硅与氢氧化钠反应生成偏铝酸钠和硅酸钠,则滤液Ⅰ为偏铝酸钠,可通入二氧化碳气体,生成氢氧化铝,煅烧可生成氧化铝.
(1)Al2O3可用于电解制Al;
(2)三氧化二铝与氢氧化钠反应生成偏铝酸钠;
(3)①偏铝酸钠与过量的CO2反应生成碳酸氢钠,碳酸氢钠与氧化钙反应生成氢氧化钠;
②Al(OH)3晶种可加速沉淀的生成;
(4)由图知Fe2+浓度为0.00004mol•L-1,可求出铝离子的浓度.
解答 解:(1)Al2O3可用于电解制Al,化学方程式是2Al2O3(熔融)═4Al+3O2↑,故答案为:2Al2O3(熔融)═4Al+3O2↑;
(2)三氧化二铝与氢氧化钠反应生成偏铝酸钠,离子方程式是Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(3)①偏铝酸钠与过量的CO2反应生成碳酸氢钠,碳酸氢钠与氧化钙反应生成氢氧化钠,可循环使用,故答案为:NaHCO3;a;
②Al(OH)3晶种可加速沉淀的生成,偏铝酸钠水解生成氢氧化铝和氢氧化钠,滤液II可直接循环使用,故答案为:滤液 II可直接循环使用;
(4)由图知Fe2+浓度为0.00004mol•L-1,铝离子的浓度为a-0.00004,铝的物质的量为(a-0.00004)×$\frac{V}{1000}$,铝元素的质量分数为$\frac{27V(a-0.0400×10{\;}^{-3})}{1000m}$,故答案为:$\frac{27V(a-0.0400×10{\;}^{-3})}{1000m}$.
点评 本题考查物质的制备和物质含量的测定,为高考常见题型和高频考点,侧重于学生的分析能力、实验能力的考查,注意把握题给信息,结合物质的性质设计实验步骤,题目难度不大.

 应用题作业本系列答案
应用题作业本系列答案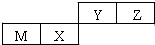
| A. | 原子半径Z>Y | |
| B. | Y的最高价氧化物对应水化物的酸性比X 的弱 | |
| C. | M和Y的最高价氧化物对应水化物之间能相互反应 | |
| D. | Y的气态氢化物比Z气态氢化物稳定 |
| X | ||
| Y | Z |
| A. | 化合物XZ3中各原子均满足8电子的稳定结构 | |
| B. | X、Y、Z三种元素形成的含氧酸都是强酸 | |
| C. | 常温下,Z单质可与Y的氢化物发生置换反应 | |
| D. | Z的气态氢化物比Y的气态氢化物更加稳定 |
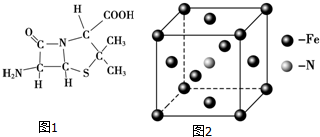
(1)Fe单质为体心立方晶体,晶胞中铁原子的配位数为8,基态铁原子有4个未成对电子,Fe3+的电子排布式为1s22s22p63s23p63d6;.
(2)硝酸钾中NO3-的空间构型为平面正三角形,写出与NO3-互为等电子体的一种非极性分子化学式BF3[SO3(g)、BBr3等].
(3)6氨基青霉烷酸的结构如图1所示,其中采用sp3杂化的原子有C、N、O、S.
(4)下列说法正确的有a(填字母序号).
a.乙醇分子间可形成氢键,导致其沸点比氯乙烷高
b.钨的配合物离子[W(CO)5OH]-能催化固定CO2,该配离子中钨显-1价
c.聚乙烯(
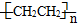 )分子中有5n个σ键
)分子中有5n个σ键d.由下表中数据可确定在反应Si(s)+O2(g)═SiO2(s)中,每生成60g SiO2放出的能量为(2c-a-b) kJ
| 化学键 | Si-Si | O═O | Si-O |
| 键能(kJ•mol-1) | a | b | c |
| A. | HCl | B. | H2SO4 | C. | H2O | D. | CaCl2 |
| A. | 54g H218O中含有电子总数为30NA个 | |
| B. | 11.2L H2中含有的电子数为NA个 | |
| C. | 23gNa+含有的最外层电子数为NA个 | |
| D. | 16g氧气和16g臭氧含有的核外电子总数均为8NA |
 ③能与水在一定条件下反应生成C
③能与水在一定条件下反应生成C
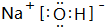 ,该化合物中所含的化学键有离子键、共价键.
,该化合物中所含的化学键有离子键、共价键.