题目内容
14.X、Y、Z三种短周期元素在周期表中的位置如图,X通过共用三对电子形成X2分子,下列说法不正确的是( )| X | ||
| Y | Z |
| A. | 化合物XZ3中各原子均满足8电子的稳定结构 | |
| B. | X、Y、Z三种元素形成的含氧酸都是强酸 | |
| C. | 常温下,Z单质可与Y的氢化物发生置换反应 | |
| D. | Z的气态氢化物比Y的气态氢化物更加稳定 |
分析 X、Y、Z是三种短周期元素,X通过共用三对电子形成X2分子,则X是N元素,根据元素在周期表中的位置知,Y是S元素、Z是Cl元素,
A.共价化合物中,中心原子价电子数+化合价的绝对值=8,则该分子中所有原子都达到8电子稳定结构,但氢化物除外;
B.X、Y、Z三种元素的最高价含氧酸是强酸,但含氧酸不一定是强酸;
C.氯气具有强氧化性,能氧化硫化氢生成S;
D.根据非金属性越强,气态氢化物的稳定性越强分析.
解答 解:X、Y、Z是三种短周期元素,X通过共用三对电子形成X2分子,则X是N元素,根据元素在周期表中的位置知,Y是S元素、Z是Cl元素,
A.共价化合物中,中心原子价电子数+化合价的绝对值=8,则该分子中所有原子都达到8电子稳定结构,但氢化物除外,化合物NCl3中N原子价电子数+化合价的绝对值=5+3=8,所以该分子中各原子均满足8电子的稳定结构,故A正确;
B.X、Y、Z三种元素的最高价含氧酸是强酸,但含氧酸不一定是强酸,如亚硝酸、亚硫酸及次氯酸都是弱酸,故B错误;
C.氯气具有强氧化性,能氧化硫化氢生成S,反应方程式为Cl2+H2S═2HCl+S,属于置换反应,故C正确;
D.由于非金属性:Cl>S,所以气态氢化物的稳定性:HCl>H2S,故D正确;
故选B.
点评 本题考查元素周期表和元素周期律综合应用,为高频考点,正确判断元素是解本题关键,明确元素性质与化合价的关系,易错选项是B,题目难度不大.

练习册系列答案
相关题目
4.由沸点数据:甲烷-146℃,乙烷-89℃,丁烷-0.5℃,戊烷36℃,可以判断丙烷的沸点可能是( )
| A. | 高于-0.5℃ | B. | 约是+30℃ | C. | 约是-40℃ | D. | 低于-89℃ |
9.下列电子式中错误的是( )
| A. | Na+ | B. |  | C. |  | D. |  |
3.化学与人类生活密切相关,下列说法正确的是( )
| A. | 苯酚有一定毒性,不能用作消毒剂和防腐剂 | |
| B. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| C. | 乙醇和乙酸都是常用调味品的主要成分 | |
| D. | 可将工业酒精兑水后饮用,因为其中含有甲醇、乙醇,它具有醇香味 |
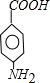 .
.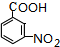 .
.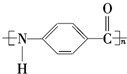 +n H2O、
+n H2O、 +2Cu(OH)2$\stackrel{△}{→}$Cu2O↓+2H2O+
+2Cu(OH)2$\stackrel{△}{→}$Cu2O↓+2H2O+ 、
、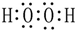 .
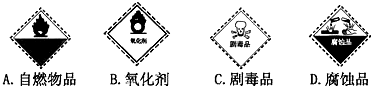
.
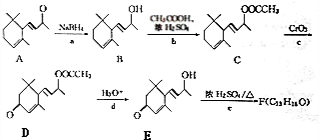
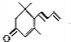 .(已知一个碳原子上不能连接两个碳碳双键)
.(已知一个碳原子上不能连接两个碳碳双键)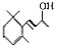 +CH3COOH$→_{△}^{浓硫酸}$、
+CH3COOH$→_{△}^{浓硫酸}$、 +H2O.
+H2O.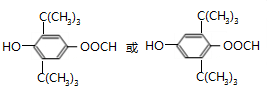
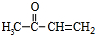 为原料制备聚1,3-丁二烯-{CH2-CH=CH-CH2}-n的合成路线.
为原料制备聚1,3-丁二烯-{CH2-CH=CH-CH2}-n的合成路线. $→_{△}^{NaOH醇溶液}$CH2=CHCH=CH2$\stackrel{一定条件}{→}$
$→_{△}^{NaOH醇溶液}$CH2=CHCH=CH2$\stackrel{一定条件}{→}$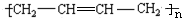 .
.