题目内容
17.四种短周期元素在周期表中的位置如图,其中只有M为金属元素.下列说法正确的是( )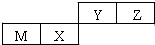
| A. | 原子半径Z>Y | |
| B. | Y的最高价氧化物对应水化物的酸性比X 的弱 | |
| C. | M和Y的最高价氧化物对应水化物之间能相互反应 | |
| D. | Y的气态氢化物比Z气态氢化物稳定 |
分析 四种短周期元素在周期表中的位置如图,其中只有M为金属元素,则M为Al,结合位置关系可知,X为Si,Y为N,Z为O,
A.同周期元素从左到右原子半径逐渐减小;
B.非金属性越强,对应的最高价氧化物的水化物酸性越强;
C.M的最高价氧化物对应水化物为Al(OH)3为两性氢氧化物;
D.非金属性越强,气态氢化物越稳定.
解答 解:四种短周期元素在周期表中的位置如图,其中只有M为金属元素,则M为Al,结合位置关系可知,X为Si,Y为N,Z为O,
A.同周期元素从左到右原子半径逐渐减小,原子半径Z<Y,故A错误;
B.非金属性Y>X,Y的最高价氧化物对应水化物的酸性比X的强,故B错误;
C.M的最高价氧化物对应水化物为Al(OH)3为两性氢氧化物,能与硝酸溶液反应,故C正确;
D.非金属性Z>Y,则Z的气态氢化物比Y气态氢化物稳定,故D错误;
故选C.
点评 本题考查位置、结构及性质的应用,为高频考点,侧重于学生的分析能力的考查,把握M为金属Al并推出各元素为解答的关键,注意元素周期律的应用及氢氧化铝的两性,题目难度不大.

练习册系列答案
相关题目
7.W、X、Y、Z是原子序数依次增大的四种短周期元素,分属于连续的四个主族,电子层数之和为10,四种原子中X原子的半径最大.下列说法正确的是( )
| A. | 四种元素中有两种元素在第二周期 | |
| B. | W所在主族的元素的原子次外层电子数不可能为18 | |
| C. | X、Y、Z的最高价氧化物对应的水化物之间能两两反应 | |
| D. | 工业上获得X、Y单质的方法主要是电解其熔融的氯化物 |
8.图为元素周期表中短周期的一部分, 四种元素中只有一种是金属,下列说法错误的是( )
四种元素中只有一种是金属,下列说法错误的是( )
 四种元素中只有一种是金属,下列说法错误的是( )
四种元素中只有一种是金属,下列说法错误的是( )| A. | 气态氢化物稳定性:R>Q | |
| B. | 元素T的离子结构示意图为 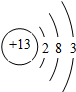 | |
| C. | 与W同主族的某元素形成的18电子的氢化物分子中既有极性键又有非极性键 | |
| D. | Q的一种同位素可用于测定文物的年代 |
12.下列关于物质性质变化的比较,不正确的是( )
| A. | 稳定性:HI>HBr>HCl>HF | B. | 原子半径大小:Na>S>O | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 还原性强弱:Cl-<Br-<I- |
9.下列电子式中错误的是( )
| A. | Na+ | B. |  | C. |  | D. |  |
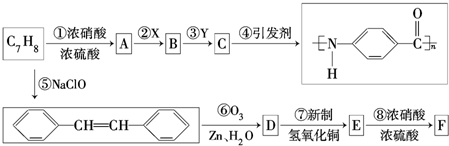
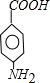 .
.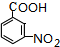 .
.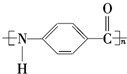 +n H2O、
+n H2O、 +2Cu(OH)2$\stackrel{△}{→}$Cu2O↓+2H2O+
+2Cu(OH)2$\stackrel{△}{→}$Cu2O↓+2H2O+ 、
、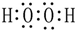 .
.