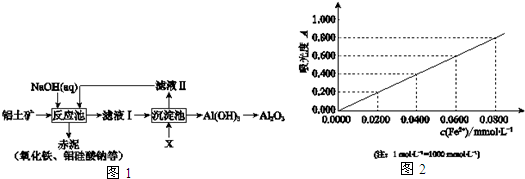
题目内容
15.A、B、C、D、E、F、G、H都是短周期主族元素,它们的核电荷数依次增大,元素A的原子核内仅有一个质子,A、E同主族,B、C、D为同周期元素,且与A元素能形成相同电子数的化合物,D与G同主族,G的质子数为D的2倍,元素F的最外层电子数比K层电子数多1.B、D、G的质子数之和等于F、H的质子数之和.请问答下列问题:(1)写出由上述至少两种元素组成的具有漂白作用的物质的化学式SO2、Na2O2、HClO、NaClO(至少写出两种).
(2)C的氧化物、G的氧化物排放到大气中会造成严重的环境问题,试举一例酸雨.
(3)A分别与G、H能形成相应的最常见二种化合物,这二种化合物的热稳定性由大到小的顺序为HCl>H2S(用化学式表示).
(4)写出由A、D、E三种元素形成的一种常见化合物的电子式
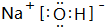 ,该化合物中所含的化学键有离子键、共价键.
,该化合物中所含的化学键有离子键、共价键.(5)B元素形成的一种常见单质与C元素最高价氧化物对应的水化物反应的方程式C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+CO2↑+2H2O.
(6)将E、F两种元素的单质同时投入水中,充分反应后,测得溶液中只有一种溶质,且无固体剩余,则所投入到水中的E的单质和F的单质的质量之比为23.
(7)配平:3G+6NaOH-2Na2G+1Na2GO3+3H2O.
分析 A、B、C、D、E、F、G、H都是短周期主族元素,它们的核电荷数依次增大,元素A的原子核内仅有一个质子,则A为H元素,A、E同主族,原子序数相差大于2,则E为Na;B、C、D为同周期元素,即处于第二周期,且与A元素能形成相同电子数的化合物,D与G同主族,G的质子数为D的2倍,则D为O元素,G为S元素,可推知B为碳元素,C为N元素;H的原子序数最大,故H为Cl.元素F的最外层电子数比K层电子数多1,最外层电子数为3,则F为Al.
解答 解:A、B、C、D、E、F、G、H都是短周期主族元素,它们的核电荷数依次增大,元素A的原子核内仅有一个质子,则A为H元素,A、E同主族,原子序数相差大于2,则E为Na;B、C、D为同周期元素,即处于第二周期,且与A元素能形成相同电子数的化合物,D与G同主族,G的质子数为D的2倍,则D为O元素,G为S元素,可推知B为碳元素,C为N元素;H的原子序数最大,故H为Cl.元素F的最外层电子数比K层电子数多1,最外层电子数为3,则F为Al.
(1)H2O2、Na2O2、NaClO、HClO、SO2等均具有漂白性,故答案为:SO2、Na2O2、HClO、NaClO;
(2)氮的氧化物、硫的氧化物排放到大气中会造成酸雨等,氮的氧化物还会导致光化学烟雾,
故答案为:酸雨;
(3)氢分别与硫、氯能形成相应的最常见二种化合物为H2S、HCl,非金属性Cl>S,故氢化物稳定性:HCl>H2S,
故答案为:HCl>H2S;
(4)由氢、氧、钠三种元素形成的一种常见化合物为NaOH,电子式为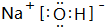 ,含有离子键、共价键,
,含有离子键、共价键,
故答案为: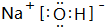 ;离子键、共价键;
;离子键、共价键;
(5)B元素形成的一种常见单质与C元素最高价氧化物对应的水化物反应的方程式:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+CO2↑+2H2O,
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+CO2↑+2H2O;
(6)将Na、Al两种元素的单质同时投入水中,充分反应后,测得溶液中只有一种溶质,且无固体剩余,该溶质为NaAlO2,则Na、Al物质的量之比为1:1,二者质量之比为23:27,
故答案为:23:27;
(7)反应方程式为:3S+6NaOH=2Na2S+Na2SO3+3H2O,
故答案为:2;6;2;1;3.
点评 本题考查位置结构性质关系及应用,推断元素的种类为解答该题的关键,熟练掌握元素周期表的结构、元素化合物性质.

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案| A. | 苯酚有一定毒性,不能用作消毒剂和防腐剂 | |
| B. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| C. | 乙醇和乙酸都是常用调味品的主要成分 | |
| D. | 可将工业酒精兑水后饮用,因为其中含有甲醇、乙醇,它具有醇香味 |
| 周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | e | f | h | |||||
| 3 | a | c | d | g | i | j | r | |
| 4 | b |
(2)a元素位于第三周期第IA族,它的元素符号是Na;
(3)e元素原子的最外层电子数为4;
(4)a、b、c三种元素的最高价氧化物对应水化物中碱性最弱的是Mg(OH)2(填化学式);
(5)h元素和i元素均可形成气态氢化物,其稳定性为H2h>H2i(填“大于”或“小于”);
(6)c元素和j元素形成化合物的化学式是MgCl2;
(7)j元素的单质跟氢气点燃的化学反应方程式:Cl2+H2$\frac{\underline{\;点燃\;}}{\;}$2HCl;
(8)b元素的单质与水反应的离子方程式:2K+2H2O=2OH-+2K++H2↑;
(9)f元素和g元素两者核电荷数之差是8.
| A. | CO2和SiO2都是直线形分子 | |
| B. | H2O和NH3的VSEPR模型不同 | |
| C. | 由分子构成的物质中一定含有共价键 | |
| D. | 形成共价键的元素不一定是非金属元素 |

 .
. .
. +n H2O、
+n H2O、 +2Cu(OH)2$\stackrel{△}{→}$Cu2O↓+2H2O+
+2Cu(OH)2$\stackrel{△}{→}$Cu2O↓+2H2O+ 、
、