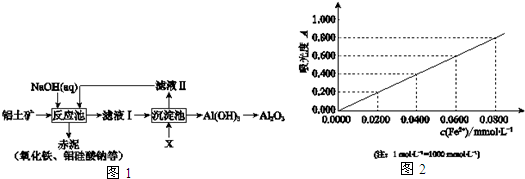
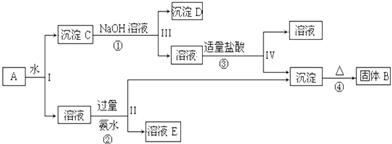
题目内容
20.合成氨反应N2(g)+3H2(g)?2NH3(g)在某温度下达列平衡时,各物质的浓度是c(N2)=3mol•L-1 ,c(H2)=9mol•L-1,c(NH3)=4mol•L-1,则:(1)该温度时的平衡常数为$\frac{16}{2187}$;起始浓度c(N2)=5mol•L-1.
(2)H2的转化率为40%.
(3)平衡后要提高H2的转化率,可以采取的合理措施有ce(填字母代号).
a.高温高压b.加入催化剂c.增加N2的浓度
d.增加H2的浓度e.分离出NH3.
分析 (1)平衡常数K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$;根据氨气的浓度计算氮气浓度变化量,起始浓度=平衡浓度+浓度变化量;
(2)转化率=$\frac{浓度变化量}{起始浓度}$×100%;
(3)平衡后要提高H2的转化率,用改变条件使平衡正向移动,但不能只增大氢气浓度,结合平衡移动原理分析.
解答 解:(1)平衡常数K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$=$\frac{{4}^{2}}{3×{9}^{3}}$=$\frac{16}{2187}$,△c(N2)=$\frac{1}{2}$△c(NH3)=$\frac{1}{2}$×4mol•L-1=2mol•L-1,则起始浓度c(N2)=3mol•L-1+2mol•L-1=5mol•L-1,
故答案为:$\frac{16}{2187}$;5mol•L-1;
(2)由方程式可知,△c(H2)=$\frac{3}{2}$△c(NH3)=$\frac{3}{2}$×4mol•L-1=6mol•L-1,氢气转化率=$\frac{6mol/L}{9mol/L+6mol/L}$×100%=40%,
故答案为:40%;
(3)a.合成氨是放热反应,升高温度平衡逆向移动,不利于氨气生成,氢气转化率减小,故a错误;
b.加入催化剂,加快反应速率,不影响平衡移动,氢气转化率不变,故b错误;
c.增加N2的浓度,平衡正向移动,氢气转化率增大,故c正确;
d.增加H2的浓度,虽然平衡正向移动,但氢气转化率减小,故d错误;
e.分离出NH3,平衡正向移动,氢气转化率增大,故e正确,
故选:ce.
点评 本题考查化学平衡计算与影响因素、化学平衡常数等,比较基础,旨在考查学生对基础知识的掌握.

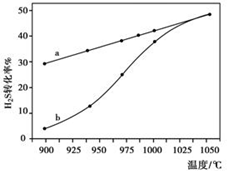
(1)方法一:H2S热分解法,反应式为:2H2S(g)?2H2(g)+S2(g)△H 在恒容密闭容器中,控制不同温度进行H2S的分解实验.H2S的起始浓度均为c mol•L-1.不同温度下反应相同时间t后,测得如图所示H2S转化率曲线图.其中a为平衡转化率与温度关系曲线,b为未达到平衡时转化率与温度的关系曲线.
①△H>0(“>”、“<”或“=”),
②若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则tmi
 n内反应速率v(H2)=$\frac{0.4c}{t}$mol/(L•min)(用含c、t的代数式表示).
n内反应速率v(H2)=$\frac{0.4c}{t}$mol/(L•min)(用含c、t的代数式表示).③请说明随温度的升高,曲线b向曲线a逼近的原因:温度的升高,反应速率加快,达到平衡所需时间缩短.
(2)方法二:以CaO为吸收体,将生物材质(以C计)与水蒸气反应制取H2.反应装置由气化炉和燃烧炉两个反应器组成,相关反应如下表所示:
| 流程1:气化炉中产生H2 | 流程2:燃烧炉中CaO再生 |
| 通入水蒸气,主要化学反应: I:C(s)+H2O(g)?CO(g)+H2(g) K1 II:CO(g)+H2O(g)?CO2(g)+H2(g) K2 III:CaO(s)+CO2(g)?CaCO3(s) K3 | 通入纯氧,主要化学反应: IV:C(s)+O2(g)=CO2(g)△H=-393.8kJ•mol-1 V:CaCO3(s)=CaO(s)+CO2(g) |
②对于可逆反应C(s)+2H2O(g)+CaO(s)?CaCO3(s)+2H2(g),△H=-87.9kJ•mol-1;采取以下措施可以提高H2产量的是AC.(填字母编号)
A.降低体系的温度 B.使各气体组分浓度均加倍
C.适当增加水蒸气的通入量 D.增加CaO的量,提高CO2的吸收率
(3)方法二与方法一相比其优点有实现了吸收剂CaO的循环,降低能耗(写一个即可).
| A. | 平衡向逆反应方向移动 | B. | 气体C的体积分数增大 | ||
| C. | m+n>p | D. | 气体A的转化率升高 |
| A. | FeCl3溶液中加入铁粉:Fe3++Fe=2Fe2+ | |
| B. | 将NH3通入H2SO4溶液中:NH3+H+=NH4+ | |
| C. | FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl- | |
| D. | H2SO4溶液与Ba(OH)2溶液混合:H++OH-=H2O |
| A. | CO2和SiO2都是直线形分子 | |
| B. | H2O和NH3的VSEPR模型不同 | |
| C. | 由分子构成的物质中一定含有共价键 | |
| D. | 形成共价键的元素不一定是非金属元素 |
| A. | 64g Cu粉与足量硫粉加热完全反应生成Cu2S时失去的电子数为2NA | |
| B. | 足量的CO2与39gNa2O2发生反应转移的电子数为NA | |
| C. | 18g的D2O与NA个-CH3具有相同的电子数 | |
| D. | 6.0g醋酸晶体中含有H+的数目为0.1NA |