题目内容
19. 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )| A. | 原子半径:rW>rZ>rY>rX | |
| B. | 含Y元素的盐溶液有的显酸性,有的显碱性 | |
| C. | 最简单气态氢化物的热稳定性:Z>W | |
| D. | 元素X的气态氢化物能与其最高价氧化物对应水化物反应 |
分析 由短周期元素X、Y、Z、W在元素周期表中的相对位置可知,W位于第三周期,其中W原子的最外层电子数是最内层电子数的3倍,则最外层电子数为6,可知W为S,结合位置可知X为N,Z为Si,Y为Al,然后结合元素周期律及元素化合物知识来解答.
解答 解:由短周期元素X、Y、Z、W在元素周期表中的相对位置可知,W位于第三周期,其中W原子的最外层电子数是最内层电子数的3倍,则最外层电子数为6,可知W为S,结合位置可知X为N,Z为Si,Y为Al,
A.同周期从左向右原子半径减小,则原子半径:rY>rZ>rW>rX,故A错误;
B.氯化铝溶液显酸性,偏铝酸钠溶液显碱性,故B正确;
C.非金属性S>Si,则最简单气态氢化物的热稳定性:Z<W,故C错误;
D.元素X的气态氢化物为氨气,能与其最高价氧化物对应水化物硝酸反应生成硝酸铵,故D正确;
故选BD.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.在一定温度下,向一个密闭的定容容器中,通入SO2、O2及合适催化剂,使之发生反应,2SO2(g)+O2(g)$\frac{\underline{\;催化剂\;}}{\;}$2SO3(g)△H=-196.6kJ•mol-1.回答下列问题:
(1)下列描述中能说明反应已达平衡状态的标志是BD.
A.v(O2)正=2v(SO3)逆
B.容器中混合气体的平均摩尔质量不再变化
C.容器中混合气体的密度不再变化
D.容器中混合气体的分子总数不再变化
(2)若在1L容器中通入3mol SO2和2mol O2,达到平衡时容器内气体压强为起始时的90%,则平衡时SO3的体积分数为22.2%,放出的热量为98.3kJkJ.该温度下的平衡常数为0.17.
(3)某定容容器中反应情况如下表:
根据表中数据比较:①温度:T1<T2(填“>”、“<”或“=”,下同).
②SO3体积分数:ω2>ω1
(4)若该反应在恒压容器中进行,到达平衡后充入Ar气(不参与反应),则反应再次达到平衡时SO2浓度减小,转化率减小(填“增大”、“减小”或“不变”).
(1)下列描述中能说明反应已达平衡状态的标志是BD.
A.v(O2)正=2v(SO3)逆
B.容器中混合气体的平均摩尔质量不再变化
C.容器中混合气体的密度不再变化
D.容器中混合气体的分子总数不再变化
(2)若在1L容器中通入3mol SO2和2mol O2,达到平衡时容器内气体压强为起始时的90%,则平衡时SO3的体积分数为22.2%,放出的热量为98.3kJkJ.该温度下的平衡常数为0.17.
(3)某定容容器中反应情况如下表:
| 温度(℃) | SO2起始浓度(mol•L-1) | O2起始浓度(mol•L-1) | 平衡时SO3 体积分数(%) |
| T1 | 2 | 1 | ω1 |
| T1 | 4 | 2 | ω2 |
| T2 | 4 | 2 | ω1 |
②SO3体积分数:ω2>ω1
(4)若该反应在恒压容器中进行,到达平衡后充入Ar气(不参与反应),则反应再次达到平衡时SO2浓度减小,转化率减小(填“增大”、“减小”或“不变”).
11.下列说法中不正确的是( )
| A. | 非金属元素形成的化合物不可能是离子化合物 | |
| B. | 金属原子和非金属原子间也可形成共价键 | |
| C. | 离子化合物中可能含有共价键 | |
| D. | 共价化合物中不能含有离子键 |
9.一定温度下,可逆反应3X(g)+Y(g)?2Z(g)达到化学平衡状态的标志是( )
| A. | 单位时间内生成3n mol X,同时消耗n mol Y | |
| B. | X的生成速率与Z的消耗速率相等 | |
| C. | X、Y、Z的浓度相等 | |
| D. | X、Y、Z的物质的量之比为3:1:2 |
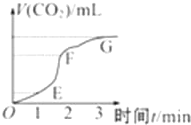 用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:
用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答: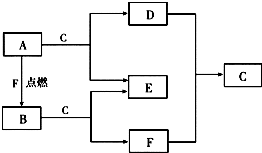 A、D、F均是由短周期元素组成的单质,常温下C是液体.
A、D、F均是由短周期元素组成的单质,常温下C是液体.