题目内容
7.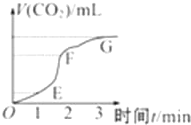 用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:
用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:( 1 )实验过程如图所示,分析判断:
EF段化学反应速率最快,EF段收集的二氧化碳气体最多.
(2)为了减缓上述反应的速率,欲向溶液中 加入下列物质,你认为可行的是AC
A.蒸馏水B.氯化钠固体 C.氯化钠溶液D.浓盐酸
(3)除了上述方法外,你认为还可以采取哪些措施来减缓化学反应速率?(至 少回答两种)
①改用较大块的碳酸钙固体;②用与盐酸不反应的物质将碳酸钙部分包住;③加入醋酸钠溶液等.
(4)盐酸与块状 CaCO3 反应时,不能使反应的最初速率明显加快的是A
A.将盐酸的用量增加一倍B.盐酸的浓度增加一倍,用量减半 C.温度升高 30℃D.改用更小块的 CaCO3.
分析 (1)根据曲线斜率判断反应速率,根据曲线高低判断收集气体的多少.
(2)根据浓度对化学反应速率的影响判断选项.
(3)根据外界条件对化学反应速率的影响确定答案,如:改变固体接触面积、改变溶液温度、改变电解质的强弱等;
(4)盐酸与块状碳酸钙固体反应时,升高温度、增大酸的浓度、增大固体的接触面积等都可加快化学反应速率.
解答 解:(1)曲线斜率大小决定反应速率大小,斜率越大,反应速率越快,所以是EF段;由曲线的高低,确定收集气体体积的大小,纵坐标越高,收集的气体越多,所以是EF段,
故答案为:EF;EF;
(2)反应物的浓度越大,反应速率越快,所以只要使反应物浓度变小即可.
A;加蒸馏水,盐酸浓度变小,反应速率减小,故A正确.
B;加氯化钠固体,盐酸浓度不变,反应速率不变,故B错误.
C.加氯化钠溶液,溶液体积增大,盐酸浓度降低,反应速率减小,故C正确.
D.加浓盐酸,盐酸浓度增大,反应速率加快,故D错误.
故选AC;
(3)还可以改变固体反应物的体积、溶液的温度、把强电解质换成弱电解质等,如①改用较大块的碳酸钙固体②用与盐酸不反应的物质将碳酸钙部分包住③加入醋酸钠溶液等,
故答案为:①改用较大块的碳酸钙固体②用与盐酸不反应的物质将碳酸钙部分包住③加入醋酸钠溶液等;
(4)A.盐酸的量增加一倍,但浓度不变,则化学反应速率不变,故A选;
B.增大浓度,可增大反应速率,故B不选;
C.升高温度,可增大反应速率,故C不选;
D.通过增大固体的表面积,可增大反应速率,故D不选.
故选A.
点评 本题考查化学反应速率的影响因素,为高频考点,把握温度、浓度对反应速率的影响为解答的关键,注重基础知识的考查,注意图象的分析,题目难度不大.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
12.推理是化学学习中常用的思维方法.以下推理正确的是( )
| A. | 碱溶液的pH大于7,Ba(OH)2是碱,所以氢氧化钡溶液的pH大于7 | |
| B. | 点燃H2和O2混合气体可能爆炸,所以点燃H2与CO的混合气体也可能爆炸 | |
| C. | 中和反应生成盐和水,所以生成盐和水的反应一定是中和反应 | |
| D. | 蜡烛燃烧生成CO2和H2O,所以蜡烛组成里一定含有碳元素、氢元素和氧元素 |
19. 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )| A. | 原子半径:rW>rZ>rY>rX | |
| B. | 含Y元素的盐溶液有的显酸性,有的显碱性 | |
| C. | 最简单气态氢化物的热稳定性:Z>W | |
| D. | 元素X的气态氢化物能与其最高价氧化物对应水化物反应 |
16.在同温同压下,下列各组热化学方程式中△H1<△H2的是( )
| A. | 2H2(g)+O2(g)═2H2O(g);△H1 2H2(g)+O2(g)═2H2O(l);△H2 | |
| B. | S(s)+O2(g)═SO2(g);△H1 S(g)+O2(g)═2SO2(g);△H2 | |
| C. | C(s)+$\frac{1}{2}$O2(g)═CO(g);△H1 C(s)+O2(g)═CO2(g);△H2 | |
| D. | H2(g)+Cl2(g)═2HCl(g);△H1 $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g);△H2 |
 人体中含量位于前6名的元素依次是:氢、氧、X、氮、钙、磷.根据要求用以上元素完成下列填空:
人体中含量位于前6名的元素依次是:氢、氧、X、氮、钙、磷.根据要求用以上元素完成下列填空: ;该分子的空间构型为正四面体结构.
;该分子的空间构型为正四面体结构.
 2CH3CHO+2H2O
2CH3CHO+2H2O