题目内容
11.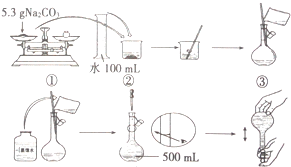 某兴趣小组为探究Na2CO3溶液的性质,需要480mL0.2mol•L-1的Na2CO3溶液.溶液的配制过程如图所示:
某兴趣小组为探究Na2CO3溶液的性质,需要480mL0.2mol•L-1的Na2CO3溶液.溶液的配制过程如图所示:(1)指出配制过程中两处明显错误称量的碳酸钠的质量应为10.6g;定容时视线应与刻度线、凹液面相切.
(2)请分析下列情况对所配溶液浓度产生的影响:其中引起所配溶液浓度偏高的有④(填序号,下同),偏低的有②⑤,无影响的是①③.
①用“左物右码”的方法称量(使用游码) ②碳酸钠不纯,其中混有氯化钠 ③容量瓶未经干燥使用 ④称量碳酸钠时所用砝码生锈 ⑤移液过程中有少量溶液溅出
(3)向标准配制的0.2mol•L-1的Na2CO3溶液50mL中,逐滴加入0.2mol•L-1的Ba(OH)2溶液50mL.该过程中发生反应的离子方程式为CO32-+Ba2+=BaCO3↓;反应后所得溶液中溶质的物质的量浓度为0.2mol•L-1(忽略溶液体积变化).
分析 (1)由于实验室无480mL容量瓶,应选用500mL容量瓶,配制出50mL的溶液,据此计算所需的碳酸钠的质量;定容时应平视;
(2)根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
(3)向标准配制的0.2mol•L-1的Na2CO3溶液50mL中,逐滴加入0.2mol•L-1的Ba(OH)2溶液50mL,两者物质的量相等,恰好完全反应生成BaCO3和NaOH,据此分析.
解答 解:(1)由于实验室无480mL容量瓶,应选用500mL容量瓶,配制出50mL的溶液,故所需的碳酸钠的质量m=CVM=0.2mol/L×0.5L×106g/mol=10.6g,故所称量的碳酸钠的质量错误;定容时应平视刻度线,使凹液面与刻度线相切,故答案为:称量的碳酸钠的质量应为10.6g;定容时视线应与刻度线、凹液面相切;
(2)①用“左物右码”的方法称量(使用游码)是正确的,故所配溶液的浓度无影响;
②碳酸钠不纯,其中混有氯化钠,则会导致碳酸钠的质量偏小,则浓度偏低;
③容量瓶未经干燥使用对浓度无影响;
④称量碳酸钠时所用砝码生锈,则砝码变重,导致称量出的药品的质量偏大,则溶液浓度偏高;
⑤移液过程中有少量溶液溅出,会导致溶质的损失,则浓度偏低.
故答案为:④;②⑤;①③;
(3)0.2mol•L-1的Na2CO3溶液50mL中,逐滴加入0.2mol•L-1的Ba(OH)2溶液50mL,两者物质的量相等,且均为0.01mol.混合后恰好完全反应生成BaCO3和NaOH:Na2CO3+Ba(OH)2=BaCO3↓+2NaOH,离子方程式为:CO32-+Ba2+=BaCO3↓.由于Na2CO3和Ba(OH)2的物质的量均为0.01mol,则生成的NaOH的物质的量为0.02mol,由于溶液体积为100mL,故浓度为c=$\frac{0.02mol}{0.1L}$=0.2mol/L.故答案为:CO32-+Ba2+=BaCO3↓;0.2mol/L.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

| A. | 锌为正极,Ag2O为负极 | B. | 锌为阳极,Ag2O为阴极 | ||
| C. | 原电池工作时,负极区PH减小 | D. | 原电池工作时,负极区PH增大 |
| A. | 葡萄糖属于糖类,能发生水解 | |
| B. | 甲烷是最简单的有机化合物 | |
| C. | 油脂有油和脂肪之分,但都属于脂 | |
| D. | 蛋白质、油脂、糖类是三大基本营养物质 |
 溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:
溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:步骤1:在a中加入15mL苯和少量铁屑,再将b中4.0mL液溴慢慢加入到a中,充分反应.
步骤2:向a中加入10mL水,然后过滤除去未反应的铁屑.
步骤3:滤液依次用10mL水、8mL 10%的NaOH溶液,10mL水洗涤,分液得粗溴苯.
步骤4:向分出的粗溴苯中加入少量的无水氯化钙、静置、过滤即得粗产品.
| 苯 | 溴 | 溴苯 | |
| 密度/gcm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中的溶解度 | 微溶 | 微溶 | 微溶 |
 +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ +HBr.
+HBr.(2)b中的液溴不能快速加入是为了防止因反应放热而使C6H6、Br2挥发(填化学式),影响产率.
(3)仪器c的作用是冷凝回流,d的作用是吸收HBr防污染防倒吸.
(4)步骤4得到的粗产品中还含有杂质苯.已知苯、溴苯的有关物理性质如上表,则要进一步提纯粗产品,还必须进行的实验操作名称是蒸馏.
| A. | 玻璃棒 | B. | 胶头滴管 | C. | 烧杯 | D. | 漏斗 |
| A. | 稀KOH溶液 | B. | HCl溶液 | C. | CuSO4溶液 | D. | NaCl溶液 |
| 操作 | 现象 | 结论 | |
| A | 滴加Ba(NO3)2溶液 | 生成白色沉淀 | 原溶液中只含SO42- |
| B | 滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+、无K+ |
| D | 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |