题目内容
6.2mol A与2mol B混合于2L的密闭容器中,发生反应:2A(g)+3B(g)?2C(g)+zD(g),若2s后反应达到平衡,A的转化率为50%,测得v(D)=0.25mol•L-1•s-1,计算:(1)用C表示的反应速率v(C)=0.25mol•L-1•s-1
(2)z=2
(3)B的转化率为75%
(4)C平衡时的物质的量为1mol.
分析 若2s后反应达到平衡,A的转化率为50%,可知转化的A为2mol×50%=1mol,v(A)=$\frac{\frac{1mol}{2L}}{2s}$=0.25mol•L-1•s-1,v(D)=0.25mol•L-1•s-1,由反应速率之比等于化学计量数之比可知z=2,则
2A(g)+3B(g)?2C(g)+2D(g)
开始 2 2 0 0
转化 1 1.5 1 1
平衡 1 0.5 1 1
结合v=$\frac{△c}{△t}$、转化率=$\frac{转化的量}{开始的量}$×100%计算.
解答 解:若2s后反应达到平衡,A的转化率为50%,可知转化的A为2mol×50%=1mol,v(A)=$\frac{\frac{1mol}{2L}}{2s}$=0.25mol•L-1•s-1,v(D)=0.25mol•L-1•s-1,由反应速率之比等于化学计量数之比可知z=2,则
2A(g)+3B(g)?2C(g)+2D(g)
开始 2 2 0 0
转化 1 1.5 1 1
平衡 1 0.5 1 1
(1)用C表示的反应速率v(C)=$\frac{\frac{1mol}{2L}}{2s}$=0.25mol•L-1•s-1,故答案为:0.25;
(2)由上述分析可知,z=2,故答案为:2;
(3)B的转化率为$\frac{1.5mol}{2mol}$×100%=75%,故答案为:75%;
(4)由上述分析可知,C平衡时的物质的量为1mol,故答案为:1.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、各物质的量的关系等为解答的关键,侧重分析与计算能力的考查,注意速率与化学计量数的关系确定z,题目难度不大.

| A. | SO2是硫及某些含硫化合物在空气中燃烧的产物 | |
| B. | SO2有漂白作用,也有杀菌作用 | |
| C. | SO2溶于水后生成H2SO4 | |
| D. | SO2是一种大气污染物 |
| A. | 50mL 0.15mol•L-1的BaCl2的溶液 | B. | 50mL 0.3mol•L-1的NaCl溶液 | ||
| C. | 25mL 0.3mol•L-1的FeCl3溶液 | D. | 75mL 0.1mol•L-1的KCl溶液 |
已知:Ksp(AgCl)=1.8×10-10;Ksp(Ag2S)=6.3×10-50.
| A. | 黑色沉淀完全转化为白色沉淀 | B. | 既有氯化银也有硫化银 | ||
| C. | 不能由黑色沉淀转化为白色沉淀 | D. | 只有氯化银白色沉淀 |
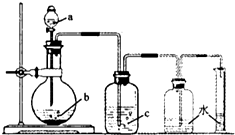 如图是制取、洗涤并测量生成气体体积的装置示意图,利用该装置进行下表所列实验,能达到实验目的是( )
如图是制取、洗涤并测量生成气体体积的装置示意图,利用该装置进行下表所列实验,能达到实验目的是( )物质 实验 | a(液体) | b(固体) | c(液体) |
| A | 稀硫酸 | 锌粒 | 浓H2SO4 |
| B | 稀硫酸 | 石灰石 | 浓H2SO4 |
| C | 浓硫酸 | Cu片 | NaOH溶液 |
| D | 稀HNO3 | Cu片 | H2O |
| A. | A | B. | B | C. | C | D. | D |