题目内容
1.把1mol X气体和0.5mol Y气体混合于2L密闭容器中,发生如下反应:3X(g)+Y(g)=nZ(g)+2W(g),2min末生成0.2mol W,若测得以Z的物质的量浓度变化表示的平均反应速率为0.1mol/(L•min),试计算:(1)前2min内,用X表示的平均反应速率;
(2)2min末时Y的转化率;
(3)化学方程式中Z的化学计量数n.
分析 2min末生成0.2mol W,v(W)=$\frac{\frac{0.2mol}{2L}}{2min}$=0.05mol/(L•min),若测得以Z的物质的量浓度变化表示的平均反应速率为0.1mol/(L•min),由速率之比等于化学计量数之比可知n=4,则
3X(g)+Y(g)=4Z(g)+2W(g)
开始 1 0.5 0 0
转化 0.3 0.1 0.4 0.2
2min 0.7 0.4 0.4 0.2
结合v=$\frac{△c}{△t}$、转化率=$\frac{转化的量}{开始的量}$×100%计算.
解答 解:2min末生成0.2mol W,v(W)=$\frac{\frac{0.2mol}{2L}}{2min}$=0.05mol/(L•min),若测得以Z的物质的量浓度变化表示的平均反应速率为0.1mol/(L•min),由速率之比等于化学计量数之比可知n=4,则
3X(g)+Y(g)=4Z(g)+2W(g)
开始 1 0.5 0 0
转化 0.3 0.1 0.4 0.2
2min 0.7 0.4 0.4 0.2
(1)2 min末生成0.2 mol W,转化的X为0.3mol,v(X)=$\frac{\frac{0.3mol}{2L}}{2min}$=0.075 mol/(L•min),
答:前2min内,用X表示的平均反应速率为0.075 mol/(L•min);
(2)2min末时Y的转化率α(Y)=$\frac{0.1mol}{0.5mol}$×100%=20%,
答:2min末时Y的转化率为20%;
(3)由上述分析可知n=4,
答:化学方程式中Z的化学计量数n为4.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、各物质的量的关系等为解答的关键,侧重分析与计算能力的考查,注意速率与化学计量数的关系确定n,题目难度不大.

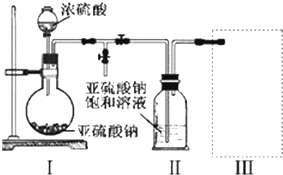
①取10mL该溶液于试管中滴加足量的Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀甲.
②取上述反应后的滤液,加人AgNO3溶液未见沉淀产生.
③另取10mL该溶液于试管中,滴加NaOH溶液产生白色沉淀乙,当加人NaOH的物质的量为0.03mol时,沉淀的量达到最大;继续滴加NaOH溶液并加热,开始产生气体丙,收集气体丙,体积换算成标况下为0.224L(假设丙全部逸出),最后沉淀完全溶解.
下列推断正确的是( )
| A. | 仅有实验①可推出肯定含有SO42-,不含Cl- | |
| B. | 该无色溶液肯定含有NH4+、K+、Al3+、SO42- | |
| C. | 该无色溶液中肯定不含K+、Mg2+、HCO3-、Cl-、MnO4-、I- | |
| D. | 不能确定该无色溶液是否含有K+ |
| A. | 32g O2 | B. | 0.2mol N2 | ||
| C. | 3.01×1023个CO2分子 | D. | 标准状况下11.2L H2O |
C(s)+H2O (g)?CO(g)+H2 (g),其化学平衡常数K和温度t的关系如表:
| t/(℃) | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)c({H}_{2})}{c({H}_{2}O)}$.
(2)能判断该反应是否达到化学平衡状态的依据是abc.
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(H2O)=c(H2)
(3)某温度下,平衡浓度符合下式:c(CO)•c(H2)=c(H2O),试判断此时的温度为830℃;在此温度下,若反应开始时H2O (g)的浓度为a mol/L,当反应达到平衡时测得CO与H2的浓度均为0.2mol/L,则反应开始时H2O的浓度a=0.24 mol/L.
| A. | 漂白粉被氧化了 | |
| B. | 有色布条被空气中的氧气氧化了 | |
| C. | 漂白粉跟空气中的 CO2反应充分,生成了较多量的 HClO | |
| D. | 漂白粉溶液蒸发掉部分水,其浓度增大 |
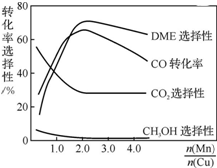 采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚(DME).观察上右图回答问题:催化剂中$\frac{n(Mn)}{n(Cu)}$约为2.0时最有利于二甲醚的合成.
采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚(DME).观察上右图回答问题:催化剂中$\frac{n(Mn)}{n(Cu)}$约为2.0时最有利于二甲醚的合成.