题目内容
11.向盛有0.1mol/L AgNO3溶液的试管中,滴加0.1mol/L Na2S溶液直至沉淀完全,再向其中滴加足量NaCl溶液,产生的现象或生成的物质是( )已知:Ksp(AgCl)=1.8×10-10;Ksp(Ag2S)=6.3×10-50.
| A. | 黑色沉淀完全转化为白色沉淀 | B. | 既有氯化银也有硫化银 | ||
| C. | 不能由黑色沉淀转化为白色沉淀 | D. | 只有氯化银白色沉淀 |
分析 由Ksp(AgCl)=1.8×10-10、Ksp(Ag2S)=6.3×10-50可知,Ag2S更难溶,则Ag2S不能转化为AgCl,以此来解答.
解答 解:盛有0.1mol/L AgNO3溶液的试管中,滴加0.1mol/L Na2S溶液直至沉淀完全,Ag+完全转化为Ag2S黑色沉淀,由Ksp(AgCl)=1.8×10-10、Ksp(Ag2S)=6.3×10-50可知,Ag2S更难溶,向其中滴加足量NaCl溶液,则Ag2S不能转化为AgCl,即不能由黑色沉淀转化为白色沉淀,
故选C.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握银离子完全沉淀及沉淀转化为解答的关键,侧重分析与应用能力的考查,注意沉淀生成与沉淀转化的判断,题目难度不大.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
2. 某些废旧塑料可采用下列方法处理,将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.
某些废旧塑料可采用下列方法处理,将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.
加热聚丙烯废塑料得到的产物如表:
(1)试管A中残余物有多种用途,如下列转化就可制取高聚物聚乙炔.
A中残留物$\stackrel{①}{→}$电石$\stackrel{②}{→}$乙炔$\stackrel{③}{→}$聚乙炔
写出反应②、③的化学方程式②CaC2+2H2O→Ca(OH)2+C2H2↑,③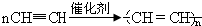 .
.
(2)试管B收集到的产品中,能使高锰酸钾酸性溶液褪色的物质是甲苯(填名称),该物质与硝酸制取一种淡黄色晶体、烈性炸药的化学方程式为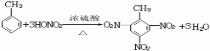 ;该物质的一氯代物有4种.
;该物质的一氯代物有4种.
(3)锥形瓶C中观察到的现象是棕黄色溶液变无色或褪色.经溴水充分吸收,剩余气体经干燥后的平均相对分子质量为4.8.
(4)写出C中逸出的气体在工业上的两种用途合成氨原料、作燃料或有机化工原料.
 某些废旧塑料可采用下列方法处理,将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.
某些废旧塑料可采用下列方法处理,将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.加热聚丙烯废塑料得到的产物如表:
| 产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
| 质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
A中残留物$\stackrel{①}{→}$电石$\stackrel{②}{→}$乙炔$\stackrel{③}{→}$聚乙炔
写出反应②、③的化学方程式②CaC2+2H2O→Ca(OH)2+C2H2↑,③
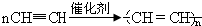 .
.(2)试管B收集到的产品中,能使高锰酸钾酸性溶液褪色的物质是甲苯(填名称),该物质与硝酸制取一种淡黄色晶体、烈性炸药的化学方程式为
 ;该物质的一氯代物有4种.
;该物质的一氯代物有4种.(3)锥形瓶C中观察到的现象是棕黄色溶液变无色或褪色.经溴水充分吸收,剩余气体经干燥后的平均相对分子质量为4.8.
(4)写出C中逸出的气体在工业上的两种用途合成氨原料、作燃料或有机化工原料.
3.用表中指定的阳极和阴极电解一定组成的甲溶液,然后加入一定量物质乙,能使溶液恢复到原来组成的甲溶液的正确组合是( )
| 组别 | 阳极 | 阴极 | 甲溶液 | 物质乙 |
| A | Ag | Cu | AgNO3溶液 | AgNO3固体 |
| B | C | Cu | CuSO4溶液 | Cu(OH)2 |
| C | Pt | Pt | NaOH溶液 | NaOH固体 |
| D | C | Fe | NaCl溶液 | HCl |
| A. | A | B. | B | C. | C | D. | D |
1.下列说法正确的是( )
| A. | 食用白糖的主要成分是蔗糖 | |
| B. | 油脂、淀粉和蛋白质都是高分子化合物 | |
| C. | 油脂不能使溴水褪色 | |
| D. | 乙酸乙酯和食用油都可以水解生成乙醇 |