题目内容
7.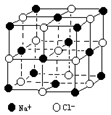 晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞.NaCl晶体结构如图所示.
晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞.NaCl晶体结构如图所示.(1)在一个NaCl晶胞中Na+的个数为4,
(2)晶体中每个Na+同时吸引着6个Cl-,每个Cl-同时吸引着6个Na+
(3)晶体中在每个Cl-周围与它最接近且距离相等的Cl-共有12个.
分析 (1)根据均摊法求得每个晶胞中离子的个数:处于顶点的离子,同时为8个晶胞共有,每个离子有1/8属于晶胞;处于棱上的离子,同时为4个晶胞共有,每个离子有1/4属于晶胞;处于面上的离子,同时为2个晶胞共有,每个离子有1/2属于晶胞;处于晶胞内部(体心)的离子,则完全属于该晶胞;
(2)根据图片确定氯化钠的配位数;
(3)每个小正方体中距离氯离子最近的氯离子有3个,顶点上的离子被8个小正方体占有,每个面上的离子被两个小正方体占有.
解答 解:(1)晶胞中顶点和面心的实心球表示Na+,Cl-位置在体心和棱的中心,根据均摊法由此可知,在NaCl晶胞中,含Cl-:12×$\frac{1}{4}$+1=4个;含Na+:8×$\frac{1}{8}$+6×$\frac{1}{2}$=4个.
故答案为:4;
(2)根据图片知,晶体中每个Na+同时吸引着 6个Cl-,每个Cl-同时吸引着6个Na+,
故答案为:6;6;
(3)每个小正方体中距离氯离子最近的氯离子有3个,顶点上的离子被8个小正方体占有,每个面上的离子被两个小正方体占有,所以晶体中在每个Cl-周围与它最接近且距离相等的Cl-共有3×8×$\frac{1}{2}$=12,
故答案为:12.
点评 本题考查了晶胞中离子配位数的判断、距离最近的同一元素离子的个数的计算等知识点,同时考查学生的空间想象能力,难点是(3)题,难度中等.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
17.下列配制的溶液浓度偏高的是( )
| A. | 配制盐酸溶液,用量筒取盐酸时俯视刻度线 | |
| B. | 配制盐酸溶液定容时,仰视容量瓶 | |
| C. | 称量4gNaOH配制0.20mol/L NaOH溶液500mL时,砝码错放左盘 | |
| D. | 配制NaOH溶液时,溶液未经冷却即注入容量瓶并定容至刻度线 |
18.下列关于胶体和溶液的说法中,不正确的是( )
| A. | 胶体和溶液都是均一、稳定的分散系,静置不易产生沉淀 | |
| B. | 胶体与纳米级微粒在直径上具有相同数量级 | |
| C. | 光线通过时,胶体产生丁达尔效应,溶液则无丁达尔效应 | |
| D. | 向Fe(OH)3胶体中逐滴加入稀硫酸无明显现象 |
15.下列有关描述或应用中,不正确的是( )
| A. | 1molNH4+的质量为18g | |
| B. | SO2的摩尔质量为64g•mol-1 | |
| C. | 铝原子的摩尔质量等于它的相对原子质量 | |
| D. | 一个水分子的质量约等于$\frac{18}{6.02×1{0}^{23}}$g |
2.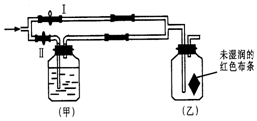 如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含有氯气的气体经过甲瓶后,再通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( )
如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含有氯气的气体经过甲瓶后,再通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( )
①浓H2SO4②饱和NaCl溶液 ③浓NaOH溶液 ④石灰水.
 如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含有氯气的气体经过甲瓶后,再通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( )
如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含有氯气的气体经过甲瓶后,再通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( ) ①浓H2SO4②饱和NaCl溶液 ③浓NaOH溶液 ④石灰水.
| A. | ① | B. | ②③④ | C. | ①③④ | D. | ③④ |
19.某原电池总反应离子方程式为2Fe3++Fe═3Fe2+,能实现该反应的原电池是( )
| A. | 正极为Cu,负极为Fe,电解质溶液为FeCl3溶液 | |
| B. | 正极为Cu,负极为Fe,电解质溶液为Fe(NO3)2溶液 | |
| C. | 正极为Fe,负极为Cu,电解质溶液为Fe2(SO4)3溶液 | |
| D. | 正极为Ag,负极为Zn,电解质溶液为CuSO4溶液 |
16.下列有关物质的性质说法正确的是( )
| A. | 碳酸氢钠比碳酸钠热稳定强 | |
| B. | Na2O2可用作供氧剂 | |
| C. | K2FeO4具有强还原性且被氧化生成Fe3+,可用于水的消毒和净水 | |
| D. | 打磨过的铝箔在空气中受热熔化,并不滴落,说明铝与氧气没有发生化学反应 |
3.表中能量表示将1mol分子完全拆解成原子所消耗的能量,
已知A2(g)与氢气化合生成1molHA(g)时放出的热量为92.5kJ,结合以上信息,下列说法正确的是( )
| 物质 | H2(g) | A2(g) | B2(g) | HA(g) | HB(g) |
| 能量(kJ) | 436 | a | 193 | 432 | 366 |
| A. | 能量最高的分子是H2 | B. | 最稳定的分子是B2 | ||
| C. | a=243 | D. | HB(g)+A2(g)═B2(g)+HA(g) 是吸热反应 |