题目内容
8.有一组物质:①NaOH、②H2O、③MgBr2、④CO2、⑤H2、⑥Na2O2、⑦H2O、⑧N2、⑨NH4Cl、⑩SO2(1)离子化合物有①③⑥⑨,共价化合物有②④⑦⑩(填编号)
(2)用电子式表示H2O和MgBr2的形成过程
H2O

MgBr2
 .
.
分析 (1)含有离子键的化合物属于离子化合物,只含有共价键的化合物属于共价化合物;
(2)水是共价化合物,分子中氢原子与氧原子之间形成1对共用电子对,用电子式表示其形成过程时,左边是原子的电子式,右边为水分子的电子式,中间用箭头连接;溴化镁是离子化合物,由钠离子与镁离子构成,用电子式表示其形成过程时,左边是原子的电子式,右边为溴化镁的电子式,中间用箭头连接.
解答 解:(1)NaOH、MgBr2、Na2O2、NH4Cl均含有离子键,属于离子化合物;H2O、CO2、H2O2、SO2只含有共价键,属于共价化合物,H2、N2不属于化合物,
故答案为:①③⑥⑨;②④⑦⑩;
(2)H2O为共价化合物,分子中氢原子与氧原子之间形成1对共用电子对,用电子式表示形成过程为 ,
,
溴化镁是离子化合物,由钠离子与镁离子构成,用电子式表示的形成过程为 ,
,
故答案为: ;
; .
.
点评 本题考查化学键、离子化合物和共价化合物的区分、用电子式的形成过程,题目难度不大,注意相关基础知识的积累.

练习册系列答案
 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
13.血液的常规检测中,测得某同学葡萄糖的浓度是2.52mmol•L-1,总胆红素的浓度是9.2μmol•L-1.葡萄糖浓度的正常范围是3.61~6.11mmol•L-1,总胆红素浓度的正常范围是0~19μmol•L-1.下列说法正确的是( )
| A. | 该同学的葡萄糖的浓度偏高 | |
| B. | 该同学的葡萄糖的浓度比总胆红素的浓度高 | |
| C. | 该同学的总胆红素的浓度比葡萄糖的浓度高 | |
| D. | 该同学的总胆红素的浓度出现异常 |
16. 硫酸是工业生产中重要的产品之一,在很多领域都有重要用途.回答下列问题:
硫酸是工业生产中重要的产品之一,在很多领域都有重要用途.回答下列问题:
(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,反应的化学方程式为4FeS2+11O2 $\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2;该反应在沸腾炉(填设备名称)中进行.
(2)为了有利于SO2转化为SO3,且能充分利用热能,可采用在有多层催化剂且有热交换器的接触室(填设备名称)中进行反应.在如图所示的装置中,C处流出的气体有SO3、SO2、O2,SO3进入吸收塔(填设备名称)中用98.3%的H2SO4吸收,得到浓硫酸或发烟硫酸.
(3)实验测得:SO2生成SO3的转化率与温度、压强的关系如表所示.已知400~600℃催化剂的催化效果较好,结合生产实际,选择最合适的生产条件是400℃,1个标准大气压
(4)欲提高SO2的反应速率和转化率,下列措施可行的是B(填选项字母).
A.向装置中通入氮气且保持体积不变
B.向装置中通入稍过量氧气且保持体积不变
C.添加更多的催化剂
D.降低温度,及时转移SO3
(5)吸收塔排出的尾气中,若SO2的含量超过500μL•L-1,就要加以处理,处理方法之一是用氨水洗涤烟气脱硫,用足量氨水吸收尾气中SO2的化学方程式为2NH3•H2O+SO2=(NH4)2SO3+H2O.
 硫酸是工业生产中重要的产品之一,在很多领域都有重要用途.回答下列问题:
硫酸是工业生产中重要的产品之一,在很多领域都有重要用途.回答下列问题:(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,反应的化学方程式为4FeS2+11O2 $\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2;该反应在沸腾炉(填设备名称)中进行.
(2)为了有利于SO2转化为SO3,且能充分利用热能,可采用在有多层催化剂且有热交换器的接触室(填设备名称)中进行反应.在如图所示的装置中,C处流出的气体有SO3、SO2、O2,SO3进入吸收塔(填设备名称)中用98.3%的H2SO4吸收,得到浓硫酸或发烟硫酸.
(3)实验测得:SO2生成SO3的转化率与温度、压强的关系如表所示.已知400~600℃催化剂的催化效果较好,结合生产实际,选择最合适的生产条件是400℃,1个标准大气压
| 压强 SO2转化率 温度 | 1.0×105Pa | 5.0×105Pa | 1.0×106Pa | 1.5×106Pa |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9989 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8528 | 0.8897 | 0.9276 | 0.9468 |
A.向装置中通入氮气且保持体积不变
B.向装置中通入稍过量氧气且保持体积不变
C.添加更多的催化剂
D.降低温度,及时转移SO3
(5)吸收塔排出的尾气中,若SO2的含量超过500μL•L-1,就要加以处理,处理方法之一是用氨水洗涤烟气脱硫,用足量氨水吸收尾气中SO2的化学方程式为2NH3•H2O+SO2=(NH4)2SO3+H2O.
3.表中能量表示将1mol分子完全拆解成原子所消耗的能量,
已知A2(g)与氢气化合生成1molHA(g)时放出的热量为92.5kJ,结合以上信息,下列说法正确的是( )
| 物质 | H2(g) | A2(g) | B2(g) | HA(g) | HB(g) |
| 能量(kJ) | 436 | a | 193 | 432 | 366 |
| A. | 能量最高的分子是H2 | B. | 最稳定的分子是B2 | ||
| C. | a=243 | D. | HB(g)+A2(g)═B2(g)+HA(g) 是吸热反应 |
13.蒸馏水的制取及检验
| 实验目的 | 实验操作 | 现象 | 结论 |
| 自来水中离子检验 | 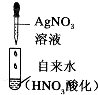 | 出现不溶于稀HNO3的沉淀 | 自来水中含氯离子 |
| 水的提纯 | 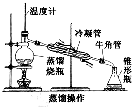 | 蒸馏烧瓶中水沸腾,冷凝管中有无色液体凝结,并通过冷凝管流入锥形瓶中 | 锥形瓶中收集到无色液体 |
| 蒸馏水中杂质离子的检验 | 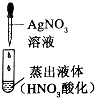 | 无明显现象 | 蒸馏水中不含氯离子 |
20.化学与科学、技术、社会、环境密切相关.下列有关说法中正确的是( )
| A. | 朝鲜第三次核试验产生的放射性物质的衰变为化学变化 | |
| B. | 燃烧化石燃料排放的废气中含大量CO2、SO2,形成酸雨 | |
| C. | 为防止垃圾污染城市,可采用露天焚烧或深埋的方法进行处理 | |
| D. | 用高纯度二氧化硅制作的光导纤维遇强碱会“断路” |
17.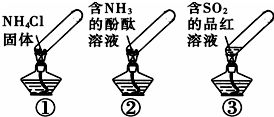 “封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是( )
“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是( )
 “封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是( )
“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是( )| A. | 加热时,①上部汇集了固体NH4Cl,说明NH4Cl的热稳定性比较好 | |
| B. | 加热时,②溶液褪色或红色变浅,冷却后又都变为红色 | |
| C. | 加热时,③溶液褪色或红色变浅,冷却后又都变为红色 | |
| D. | 三个“封管实验”中所发生的化学反应都是可逆反应 |