题目内容
7. 为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应.
为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应.乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还可能含有少量还原性的杂质气体,由此他提出必须先除去之,再与溴水反应.
请你回答下列问题:
(1)写出甲同学实验中两个主要的化学方程式CaC2+2H2O→Ca(OH)2+C2H2↑、
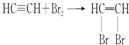
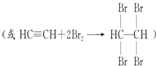 .
.(2)甲同学设计的实验不能(填能或不能)验证乙炔与溴发生加成反应,其理由是ac(多选扣分).
(a)使溴水褪色的反应,未必是加成反应
(b)使溴水褪色的反应,就是加成反应
(c)使溴水褪色的物质,未必是乙炔
(d)使溴水褪色的物质,就是乙炔
(3)乙同学推测此乙炔中必定含有的一种含硫的杂质气体(写分子式),它与溴水反应的化学方程式Br2+H2S═S↓+2HBr;在验证过程中必须全部除去.
(4)请你选用下列四个装置(可重复使用)来实现乙同学的实验方案,将它们的编号填入方框,并写出装置内所放的化学试剂(自选):
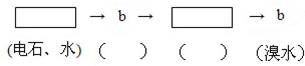
(5)为验证乙炔与溴的反应是加成而不是取代,丙同学提出可比较反应前后溶液的酸性,理由是如若发生取代反应,必定生成HBr,溶液酸性将会明显增强,故可用pH试纸验证.
分析 (1)碳化钙能与水反应生成乙炔,乙炔具有不饱和键,能与溴水发生加成反应而使溴水褪色;
(2)生成的乙炔中混有硫化氢气体,可与溴水发生氧化还原反应而使溴水褪色;
(3)电石中含有硫化物,与水反应生成硫化氢气体;
(4)实现乙同学的方案应用硫酸铜溶液除去硫化氢并检验是否完全除尽,之后再用溴水检验是否生成乙炔;
(5)根据取代反应的特征是:有去有回来回答.
解答 解:(1)碳化钙能与水反应生成乙炔和水,反应方程式为CaC2+2H2O→Ca(OH)2+C2H2↑,乙炔具有不饱和键,能与溴水发生加成反应而使溴水褪色,反应方程式为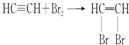
 ,
,
故答案为:CaC2+2H2O→Ca(OH)2+C2H2↑;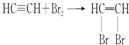
 ;
;
(2)生成的乙炔中混有硫化氢气体,可与溴水发生氧化还原反应而使溴水褪色,
故答案为:不能;ac;
(3)电石中含有硫化物,与水反应生成硫化氢气体,硫化氢气体具有还原性,能与溴水发生氧化还原反应生成硫和溴化氢,反应方程式为Br2+H2S═S↓+2HBr,
故答案为:H2S;Br2+H2S═S↓+2HBr;
(4)实现乙同学的方案应用硫酸铜溶液除去硫化氢并检验是否完全除尽,之后再用溴水检验是否生成乙炔,选择c做为发生装置,选择b作为除杂和检验装置,
故答案为: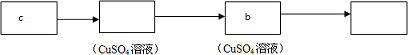
(5)为验证这一反应是加成而不是取代,丙同学提出可用pH试纸来测试反应后溶液的酸性,如若发生取代反应,必定生成HBr,溶液酸性将会明显增强,故可用pH试纸验证;
故答案为:如若发生取代反应,必定生成HBr,溶液酸性将会明显增强,故可用pH试纸验证.
点评 本题考查了乙炔的制备和性质实验,题目难度不大,本题中注意乙炔的除杂和性质实验,注意与溴水反应的性质.

练习册系列答案
相关题目
13.有机物 在不同条件下至少可能发生7种不同类型的反应:①取代 ②加成 ③消去 ④氧化 ⑤酯化 ⑥加聚 ⑦缩聚,其中由于其分子结构中含有-OH,可能发生的反应有( )
在不同条件下至少可能发生7种不同类型的反应:①取代 ②加成 ③消去 ④氧化 ⑤酯化 ⑥加聚 ⑦缩聚,其中由于其分子结构中含有-OH,可能发生的反应有( )
 在不同条件下至少可能发生7种不同类型的反应:①取代 ②加成 ③消去 ④氧化 ⑤酯化 ⑥加聚 ⑦缩聚,其中由于其分子结构中含有-OH,可能发生的反应有( )
在不同条件下至少可能发生7种不同类型的反应:①取代 ②加成 ③消去 ④氧化 ⑤酯化 ⑥加聚 ⑦缩聚,其中由于其分子结构中含有-OH,可能发生的反应有( )| A. | ②④⑥⑦ | B. | ③④⑤⑥ | C. | ②③④⑤ | D. | ①③④⑤⑦ |
18.在水电离出的c(H+)=1×10-12mol/L的溶液中,一定能大量共存的离子组是( )
| A. | Al3+、Na+、SO42-、Cl- | B. | Na+、K+、CO32-、SO42- | ||
| C. | K+、NH4+、Cl-、NO3- | D. | Na+、Ba2+、Cl-、NO3- |
15.在下列饱和溶液中分别持续通入CO2,始终不会有沉淀或晶体析出的是( )
| A. | Na2SiO3 | B. | Ca(OH)2 | C. | Ca(NO3)2 | D. | Na2CO3 |
2.下列化合物,按其晶体的熔点由高到低排列正确的是( )
| A. | SiO2 CsCl CBr4 CF4 | B. | SiO2 CsCl CF4 CBr4 | ||
| C. | CsCl SiO2 CBr4 CF4 | D. | CF4CBr4CsCl SiO2 |
16.下列说法中正确的是( )
| A. | 电子云示意图中的小黑点表示原子核最外层的电子 | |
| B. | 某元素有多种同位素,天然存在的该元素其中一种同位素的丰度为75%,则100 g天然存在的该元素中,此同位素的质量为75 g | |
| C. | 核外电子的运动状态是由该电子的电子层、电子亚层、电子云的伸展方向和电子自旋方向共同决定的 | |
| D. | 电子离核越远能量越高,所以N层电子的能量一定高于M层电子的能量 |
17.下列叙述正确的是( )
| A. | 浓度均为0.1 mol•L-1的CH3COOH和CH3COONa溶液等体积混合所得的溶液中:c(CH3COOH)+c(CH3COO-)═0.2 mol•L-1 | |
| B. | 0.1 mol•L-1 NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-) | |
| C. | 0.2 mol•L-1 HCl溶液与等体积0.1 mol•L-1 NaOH溶液混合后,溶液的pH=1 | |
| D. | 0.1 mol•L-1氨水中滴入0.1 mol•L-1盐酸至溶液呈中性时:c(NH4+)=c(Cl-) |

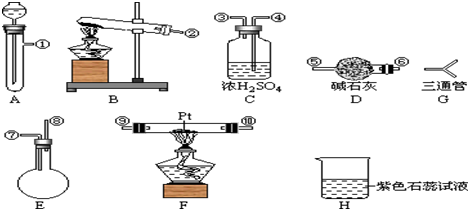
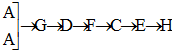 [按装置先后顺序排列]
[按装置先后顺序排列]