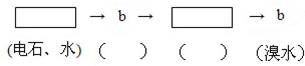题目内容
2.下列化合物,按其晶体的熔点由高到低排列正确的是( )| A. | SiO2 CsCl CBr4 CF4 | B. | SiO2 CsCl CF4 CBr4 | ||
| C. | CsCl SiO2 CBr4 CF4 | D. | CF4CBr4CsCl SiO2 |
分析 不同晶体的熔点:一般为原子晶体>离子晶体>金属晶体>分子晶体;相同晶体从影响晶体熔沸点高低的因素分析.
解答 解:SiO2为原子晶体,CsCl为离子晶体,不同晶体的熔点:一般为原子晶体>离子晶体>金属晶体>分子晶体,
则SiO2熔点最高,其次为CsCl,CBr4和CF4都为分子晶体,分子的相对分子质量越大,分子间作用力越强,熔点越高,
则熔点:CBr4>CF4,
固有:SiO2>CsCl>CBr4>CF4,
故选A.
点评 本题考查晶体的类型与熔沸点的比较,题目难度不大,解答该类题目时要首先判断晶体的类型,晶体类型相同时,要注意晶体结构是否相似,把握影响晶体熔沸点的因素.

练习册系列答案
 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
13.甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究.
(1)B中反应的离子方程式是Cl2+2OH-═Cl-+ClO-+H2O.
(2)A中溶液变红的原因是Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色的,所以溶液变红.
(3)为了探究现象II的原因,甲同学进行如下实验.
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在.
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液.
甲同学的实验证明产生现象Ⅱ的原因是SCN-与Cl2发生了反应.
(4)甲同学猜想SCN-可能被Cl2氧化了,他又进行了如下研究.
资料显示:SCN-的电子式为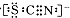
①甲同学认为SCN-中碳元素没有被氧化,理由是SCN-中的碳元素是最高价态+4价.
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN-中被氧化的元素是硫元素.
③通过实验证明了SCN-中氮元素转化为NO3-.
④若SCN-与Cl2反应生成1mol CO2,则转移电子的物质的量是16mol.
| 操 作 | 现 象 |
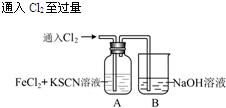 | I.A中溶液变红 Ⅱ.稍后,溶液由红色变为黄色 |
(2)A中溶液变红的原因是Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色的,所以溶液变红.
(3)为了探究现象II的原因,甲同学进行如下实验.
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在.
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液.
甲同学的实验证明产生现象Ⅱ的原因是SCN-与Cl2发生了反应.
(4)甲同学猜想SCN-可能被Cl2氧化了,他又进行了如下研究.
资料显示:SCN-的电子式为
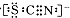
①甲同学认为SCN-中碳元素没有被氧化,理由是SCN-中的碳元素是最高价态+4价.
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN-中被氧化的元素是硫元素.
③通过实验证明了SCN-中氮元素转化为NO3-.
④若SCN-与Cl2反应生成1mol CO2,则转移电子的物质的量是16mol.
10.已知:①MnO4-在酸性环境下的还原产物是Mn2+;②草酸是二元弱酸.某校化学兴趣小组进行了下列二项实验活动:
I.探究草酸与髙锰酸钾溶液在不同条件下反应的快慢
取4支试管,分别加入0.10mol/L的草酸溶液5mL,按以下表中四种方案分别加人相 应的试剂,使其发生反应.四支试管中均可观察到有气泡产生,且溶液的颜色变化都 为:紫红色→红色→橙红色→橙色→黄色→无色,溶液褪为无色所需的时间如表所 示(表中“一”表示未加入该试剂).
根据以上4组实验,可以得出的结论主要有稀硫酸可以使上述反应速率加快,升温反应速率加快且温度升高10°C反应速率增大为原来的2.25倍,Mn2+做该反应的催化剂,可加快反应速率
II.测定草酸晶体的纯度
用托盘天平称取草酸晶体(H2C2O4•2H2O)W g;配制成250mL溶液;每次移取25.00mL该溶液于锥形瓶中,用0.10moI/L酸性高锰酸钾溶液滴定;滴定实验重复操 作2~3次.请回答:
(1)实验中需要用到的玻璃仪器除了玻璃棒、烧杯、锥形瓶、胶头滴管、250mL容量瓶 外还需要的一种玻璃仪器是酸式滴定管
(2)上述H2C2O4溶液与酸性KMnO4溶液反应的离子方程为5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑++8H2O.
(3)若滴定过程中平均消耗酸性髙锰酸钾溶液VmL,则草酸晶体的纯度为$\frac{31.5V}{W}%$(以含W、V的表达式表示).
I.探究草酸与髙锰酸钾溶液在不同条件下反应的快慢
取4支试管,分别加入0.10mol/L的草酸溶液5mL,按以下表中四种方案分别加人相 应的试剂,使其发生反应.四支试管中均可观察到有气泡产生,且溶液的颜色变化都 为:紫红色→红色→橙红色→橙色→黄色→无色,溶液褪为无色所需的时间如表所 示(表中“一”表示未加入该试剂).
| 实验 编号 | 反应温度 (利用水浴加热) | 稀硫酸 溶液 | MnSO4固体 | 0.10mol/L KMnO4溶液 | 褪色 时间 |
| 1 | 65℃ | ---- | --- | 1mL | 100s |
| 2 | 65℃ | 10滴 | --- | 1mL | 90s |
| 3 | 75℃ | 10滴 | ---- | 1mL | 40s |
| 4 | 75℃ | 10滴 | 加入少许 | 1mL | 3s |
II.测定草酸晶体的纯度
用托盘天平称取草酸晶体(H2C2O4•2H2O)W g;配制成250mL溶液;每次移取25.00mL该溶液于锥形瓶中,用0.10moI/L酸性高锰酸钾溶液滴定;滴定实验重复操 作2~3次.请回答:
(1)实验中需要用到的玻璃仪器除了玻璃棒、烧杯、锥形瓶、胶头滴管、250mL容量瓶 外还需要的一种玻璃仪器是酸式滴定管
(2)上述H2C2O4溶液与酸性KMnO4溶液反应的离子方程为5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑++8H2O.
(3)若滴定过程中平均消耗酸性髙锰酸钾溶液VmL,则草酸晶体的纯度为$\frac{31.5V}{W}%$(以含W、V的表达式表示).
17.根据所学规律,你认为下列物质在水中溶解度较大的是( )
| A. | 甲烷 | B. | 二氧化碳 | C. | 二氧化硫 | D. | 氢气 |
11.某炔烃与氢气加成后生成2-甲基戊烷,该炔烃可能的结构有( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
12.在一定条件下发生下列反应,其中属于盐类水解反应的是( )
| A. | NH4++2H2O?NH3•H2O+H3O+ | B. | AlO2-+HCO3-+H2O═Al(OH)3↓+CO32- | ||
| C. | HS-+H+?H2S | D. | Cl2+H2O?H++Cl-+HClO |
 为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应.
为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应.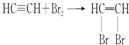
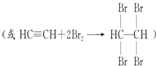 .
.