题目内容
17.下列叙述正确的是( )| A. | 浓度均为0.1 mol•L-1的CH3COOH和CH3COONa溶液等体积混合所得的溶液中:c(CH3COOH)+c(CH3COO-)═0.2 mol•L-1 | |
| B. | 0.1 mol•L-1 NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-) | |
| C. | 0.2 mol•L-1 HCl溶液与等体积0.1 mol•L-1 NaOH溶液混合后,溶液的pH=1 | |
| D. | 0.1 mol•L-1氨水中滴入0.1 mol•L-1盐酸至溶液呈中性时:c(NH4+)=c(Cl-) |
分析 A.根据混合液中的物料守恒判断;
B.根据碳酸氢钠溶液中的物料守恒分析;
C.混合液中氢离子浓度为0.05mol/L,溶液的pH>1;
D.反应后溶液呈中性,则c(H+)=c(OH-),结合电荷守恒判断.
解答 解:A.浓度均为0.1 mol•L-1的CH3COOH和CH3COONa溶液等体积混合所得的溶液中,根据物料守恒可得:c(CH3COOH)+c(CH3COO-)═0.1mol•L-1,故A错误;
B.0.1 mol•L-1 NaHCO3溶液中,根据物料守恒可得:c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-),故B错误;
C.0.2 mol•L-1 HCl溶液与等体积0.1 mol•L-1NaOH溶液混合后,溶液中氢离子浓度为:$\frac{0.2mol/L-0.1mol/L}{2}$=0.05mol/L,溶液的pH>1,故C错误;
D.0.1 mol•L-1氨水中滴入0.1 mol•L-1盐酸至溶液呈中性时:c(H+)=c(OH-),根据电荷守恒可知c(NH4+)=c(Cl-),故D正确;
故选D.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒的含义及应用方法为解答关键,C为易错点,注意正确计算混合液中氢离子浓度,试题培养了学生的分析、理解能力及化学计算能力.

练习册系列答案
相关题目
5.分别用等质量的金属钠进行下列实验,其中生成氢气的体积(同温同压)最大的是( )
| A. | 将钠投入到足量水中 | |
| B. | 将钠用铝箔包好并刺一些小孔,再放入足量水中 | |
| C. | 将钠放入足量稀硫酸中 | |
| D. | 将钠放入足量氢氧化钠溶液中 |
12.在一定条件下发生下列反应,其中属于盐类水解反应的是( )
| A. | NH4++2H2O?NH3•H2O+H3O+ | B. | AlO2-+HCO3-+H2O═Al(OH)3↓+CO32- | ||
| C. | HS-+H+?H2S | D. | Cl2+H2O?H++Cl-+HClO |
2.向明矾溶液中滴入氢氧化钡溶液,当SO42-沉淀完全时,铝元素的存在形式是( )
| A. | Al(OH)3 和Al3+ | B. | Al(OH)3 和AlO2- | C. | 全部为Al(OH)3 | D. | 全部为AlO2- |
6.清洁燃料主要有两类,一类是压缩天然气(CNG),另一类是液化石油气(LPG).其主要成分都是( )
| A. | 氢气 | B. | 碳水化合物 | C. | 碳氢化合物 | D. | 醇类 |
7.标准状况下0.05mol某一无色可燃气体在足量氧气中完全燃烧.若将产物通过足量的澄清石灰水中,得到的白色沉淀为0.15mol;若用足量碱石灰吸收燃烧产物,增重9.3g.
(1)计算燃烧产物中水的质量.
(2)此气体的化学式是C3H6.
(3)写出表示此气体燃烧热的热化学方程式C2H4(g)+3O2(g)=2CO2(g)+2H2O(l)△H=-1411kJ/mol.
| 可能用到的燃烧热 | C2H4 | C3H6 | C3H8 |
| 单位/kJ•mol-1 | 1411 | 2092 | 2220 |
(2)此气体的化学式是C3H6.
(3)写出表示此气体燃烧热的热化学方程式C2H4(g)+3O2(g)=2CO2(g)+2H2O(l)△H=-1411kJ/mol.
 为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应.
为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应.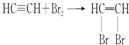
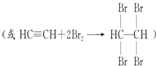 .
.