题目内容
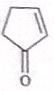
10. 已知可逆反应X(g)+Y(g)?2Z(g),在容积为2L 的密闭容器中反应,有关物质的物质的量的变化如图所示.下列叙述正确的是( )
已知可逆反应X(g)+Y(g)?2Z(g),在容积为2L 的密闭容器中反应,有关物质的物质的量的变化如图所示.下列叙述正确的是( )| A. | a为1.60 | |
| B. | X和Y的转化率相等 | |
| C. | 0~10min的平均速率V(Z)=0.079mol•L-1•min-1 | |
| D. | 容器内Z的浓度最大可以达到1.00 mol/L |
分析 图象分析可知XY为反应物,Z为生成物,XY的起始量为1.20mol,1.00mol,达到平衡状态X为0.41mol,Y为0.21mol,反应消耗X物质的量=1.20mol-0.41mol=0.79mol,消耗Y物质的量=1.00mol-0.21mol=0.79mol,
X(g)+Y(g)?2Z(g),
起始量(mol) 1.20 1.00 0
变化量(mol) 0.79 0.79 a=0.79×2=1.58
平衡量(mol) 0.41 0.21 1.58
A.上述计算得到a为1.58;
B.转化率=$\frac{消耗量}{起始量}$×100%;
C.反应速率v=$\frac{△c}{△t}$;
D.反应是可逆反应,XY比较,若Y全部转化生成Z物质的量为2mol,浓度为1mol/L.
解答 解:图象分析可知XY为反应物,Z为生成物,XY的起始量为1.20mol,1.00mol,达到平衡状态X为0.41mol,Y为0.21mol,反应消耗X物质的量=1.20mol-0.41mol=0.79mol,消耗Y物质的量=1.00mol-0.21mol=0.79mol,
X(g)+Y(g)?2Z(g),
起始量(mol) 1.20 1.00 0
变化量(mol) 0.79 0.79 a=0.79×2=1.58
平衡量(mol) 0.41 0.21 1.58
A.上述计算得到a为1.58,故A错误;
B.X转化率=$\frac{消耗量}{起始量}$×100%=$\frac{0.79mol}{1.20mol}$×100%=65.8%,Y转化率=$\frac{消耗量}{起始量}$×100%=$\frac{0.79mol}{1.00mol}$×100%=79%,转化率不同,故B错误;
C.Z反应速率v=$\frac{△c}{△t}$=$\frac{\frac{1.58mol}{2L}}{10min}$=0.079mol/L•min,故C正确;
D.反应是可逆反应,XY比较,若Y全部转化生成Z物质的量为2mol,浓度为1mol/L,反应是可逆反应不能进行彻底,容器内Z的浓度最大不能达到1.00 mol/L,故D错误;
故选C.
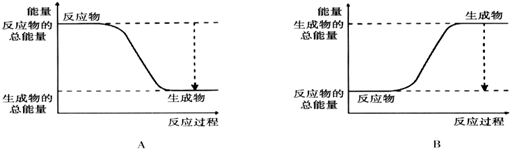
点评 本题考查了化学图象分析,化学反应速率、转化率等的计算,化学平衡判断和三行计算方法的应用,注意可逆反应不能进行彻底,题目难度中等.

 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ⑥ | ⑦ | ⑩ | |||||
| 三 | ① | ③ | ⑤ | ④ | ⑧ | ⑪ | ||
| 四 | ② | ⑨ |
(2)①②⑤中,最高价氧化物对应的水化物碱性最强的是KOH.(写化学式)
⑧⑨⑩对应的气态氢化物的稳定性从大到小的顺序是HF>HCl>HBr.(用化学式表示)
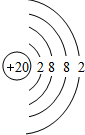
(3)元素⑦的氢化物电子式为
 ,该氢化物与其最高价含氧酸反应生成的化合物中含有的化学键类型是离子键、共价键,属于离子化合物(填“离子”或“共价”)
,该氢化物与其最高价含氧酸反应生成的化合物中含有的化学键类型是离子键、共价键,属于离子化合物(填“离子”或“共价”)(4)判断元素④和⑧对应的常见单质氧化性的强弱Cl2>S(用化学式表示),并用化学方程式阐明你的判断:Na2S+Cl2=2NaCl+S.

| A. | 原子半径的大小顺序是C>B>A>D | |
| B. | B、D之间只能形成一种化合物 | |
| C. | 只有A的单质存在同素异形体 | |
| D. | A、B、C的最高价氧化物对应水化物的酸性强弱的关系是C>B>A |
| A. | NaOH | B. | SiO2 | C. | Mg | D. | CH4 |
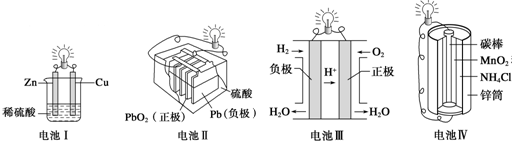
| A. | 电池Ⅰ中锌是负极 | |
| B. | 电池Ⅱ是一次电池 | |
| C. | 电池Ⅲ工作时氢气发生还原反应 | |
| D. | 电池Ⅳ工作时电子由锌通过导线流向碳棒 |
| A. | 滴加了酚酞的溶液变红色 | B. | 产生气体推动Na游动 | ||
| C. | Na沉在水下 | D. | Na熔成光亮小球 |
 )具有高度对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点.下面是立方烷衍生物Ⅰ的一种合成路线:
)具有高度对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点.下面是立方烷衍生物Ⅰ的一种合成路线: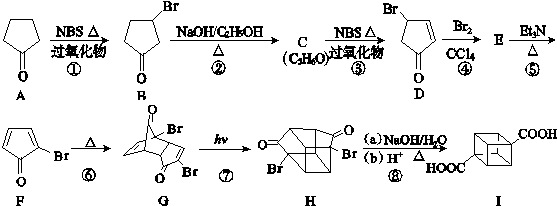
 ,E的结构简式为
,E的结构简式为 .
.
 ;
; .
.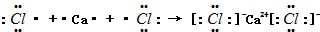 .
.