题目内容
15.某元素的核素AZX,2.22g其氯化物XCl2溶于水后,加入40mL 1mol/L硝酸银溶液,恰好将其中的Cl-完全沉淀.已知该核素中的质子数和中子数相等.试通过计算回答下列问题:(1)A=40,X元素的原子序数为20,原子结构示意图为
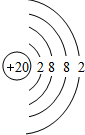 .
.(请在下面写出计算过程)
(2)用电子式表示出XCl2的形成过程
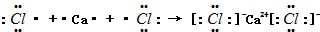 .
.
分析 由Cl-+Ag+═AgCl↓可知,n(Cl-)=n(Ag+)=0.04L×1mol/L=0.04mol,则n(XCl2)=$\frac{1}{2}$n(Cl-)=$\frac{1}{2}$×0.04mol=0.02mol,则M(XCl2)=$\frac{2.22g}{0.02mol}$=111g/mol,所以XCl2相对分子质量为111,故X的相对原子质量=111-35.5×2=40,即X的质量数为40,X的质子数=质量数-中子数=40-20=20,故X为Ca元素,据此解答.
解答 解:由Cl-+Ag+═AgCl↓可知,n(Cl-)=n(Ag+)=0.04L×1mol/L=0.04mol,则n(XCl2)=$\frac{1}{2}$n(Cl-)=$\frac{1}{2}$×0.04mol=0.02mol,则M(XCl2)=$\frac{2.22g}{0.02mol}$=111g/mol,所以XCl2相对分子质量为111,故X的相对原子质量=111-35.5×2=40,即X的质量数为40,X的质子数=质量数-中子数=40-20=20,故X为Ca元素,其原子结构示意图为: ,
,
故答案为:40;20; ;
;
(2)CaCl2属于离子化合物,用电子式表示CaCl2的形成过程为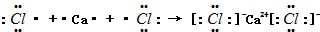 ,
,
故答案为: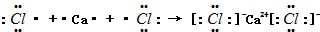 .
.
点评 本题考查离子方程式的计算、结构性质位置关系应用、常用化学用语等,难度不大,注意掌握用电子式表示化学键或物质的形成过程.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.由2-氯丙烷制得少量 需要经过下列几步反应( )
需要经过下列几步反应( )
 需要经过下列几步反应( )
需要经过下列几步反应( )| A. | 加成 消去 取代 | B. | 消去 加成 水解 | C. | 取代 消去 加成 | D. | 消去 加成 消去 |
6.下列每组各有三对物质,它们都能用分液漏斗分离的是( )
| A. | 乙酸乙酯和水,酒精和水,苯酚和水 | |
| B. | 二溴乙烷和水,溴苯和水,硝基苯和水 | |
| C. | 甘油和水,乙醛和水,乙酸和乙醇 | |
| D. | 醋酸和水,甲苯和水,己烷和水 |
3.在一定温度下的定容容器中,发生反应:2A(g)+B(s)?C(g)+D(g),下列描述中能表明反应已达到平衡状态的是( )
①混合气体的压强不变②混合气体的密度不变③B 的物质的量浓度不变
④容器内A的百分含量为20%的状态 ⑤单位时间内生成n molD,同时生成2n molA.
⑥单位时间内生成n molC,同时消耗n molD.
①混合气体的压强不变②混合气体的密度不变③B 的物质的量浓度不变
④容器内A的百分含量为20%的状态 ⑤单位时间内生成n molD,同时生成2n molA.
⑥单位时间内生成n molC,同时消耗n molD.
| A. | ②⑤⑥ | B. | ③④⑥ | C. | ①②③ | D. | 只有③ |
10. 已知可逆反应X(g)+Y(g)?2Z(g),在容积为2L 的密闭容器中反应,有关物质的物质的量的变化如图所示.下列叙述正确的是( )
已知可逆反应X(g)+Y(g)?2Z(g),在容积为2L 的密闭容器中反应,有关物质的物质的量的变化如图所示.下列叙述正确的是( )
 已知可逆反应X(g)+Y(g)?2Z(g),在容积为2L 的密闭容器中反应,有关物质的物质的量的变化如图所示.下列叙述正确的是( )
已知可逆反应X(g)+Y(g)?2Z(g),在容积为2L 的密闭容器中反应,有关物质的物质的量的变化如图所示.下列叙述正确的是( )| A. | a为1.60 | |
| B. | X和Y的转化率相等 | |
| C. | 0~10min的平均速率V(Z)=0.079mol•L-1•min-1 | |
| D. | 容器内Z的浓度最大可以达到1.00 mol/L |
20.海水淡化后,为检验所得的淡水中是否含有氯离子,通常采用的试剂是( )
| A. | AgNO3溶液 | B. | AgNO3溶液和稀盐酸 | ||
| C. | AgNO3溶液和稀硝酸 | D. | 以上试剂均可 |
7.下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
(1)写出⑧的原子结构示意图 .
.
(2)④、⑤、⑥的原子半径由大到小的顺序为Na>Al>O(用元素符号回答).
(3)②、③、⑦的最高价含氧酸的酸性由强到弱顺序是HNO3>H2CO3>H2SiO3(用化学式回答)
(4)③元素所形成单质的结构式为N≡N.
(5)⑥的单质与①、⑨两种元素形成化合物的水溶液反应的离子方程式为:2Al+6H+=2Al3++3H2↑.
(6)⑤元素与⑨元素形成的化合物中,化学键类型为离子键.
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
 .
.(2)④、⑤、⑥的原子半径由大到小的顺序为Na>Al>O(用元素符号回答).
(3)②、③、⑦的最高价含氧酸的酸性由强到弱顺序是HNO3>H2CO3>H2SiO3(用化学式回答)
(4)③元素所形成单质的结构式为N≡N.
(5)⑥的单质与①、⑨两种元素形成化合物的水溶液反应的离子方程式为:2Al+6H+=2Al3++3H2↑.
(6)⑤元素与⑨元素形成的化合物中,化学键类型为离子键.
4.下列有机物分子中,在质子核磁共振谱中只给出一种峰(信号)的是( )
| A. | CH3OH | B. | CH3COOCH3 | C. | C(CH3)4 | D. | CH3COOH |
5.50℃时的KCl饱和溶液,降低10℃,下列因素不发生变化的是( )
| A. | 溶解度 | B. | 溶质的质量分数 | C. | 溶剂的质量 | D. | 溶液的质量 |