题目内容
将Cl2通入100mL NaOH溶液中充分反应,生成0.1mol的NaCl,下列说法正确的是( )
| A、反应后溶液中ClO-的个数为0.1NA |
| B、原NaOH浓度为1mol/L |
| C、参加反应的氯气分子为0.1NA |
| D、转移电子为0.2NA |
考点:化学方程式的有关计算,氯气的化学性质
专题:计算题
分析:将Cl2通入100mL NaOH溶液中充分反应,生成0.1mol的NaCl,发生Cl2+2NaOH=NaClO+NaCl+H2O,结合N=nNA、c=
计算.
| n |
| V |
解答:
解:发生Cl2+2NaOH=NaClO+NaCl+H2O,生成0.1molNaCl的同时,生成0.1molNaClO,消耗2molNaOH,
A.生成0.1molNaClO,阴离子水解,则反应后溶液中ClO-的个数小于0.1NA,故A错误;
B.若恰好完全反应,则原NaOH浓度为
=2mol/L,故B错误;
C.由反应可知,参加反应的氯气为0.1mol,则参加反应的氯气分子为0.1NA,故C正确;
D.Cl元素的化合价既升高又降低,转移0.1mol电子,则转移电子为0.1NA,故D错误;
故选C.
A.生成0.1molNaClO,阴离子水解,则反应后溶液中ClO-的个数小于0.1NA,故A错误;
B.若恰好完全反应,则原NaOH浓度为
| 0.2mol |
| 0.1L |
C.由反应可知,参加反应的氯气为0.1mol,则参加反应的氯气分子为0.1NA,故C正确;
D.Cl元素的化合价既升高又降低,转移0.1mol电子,则转移电子为0.1NA,故D错误;
故选C.
点评:本题考查氯气的性质及化学反应方程式的计算,为高频考点,把握发生的化学反应及物质的量为中心的计算为解答的关键,侧重分析能力、计算能力的考查,题目难度不大.

练习册系列答案
相关题目
下列说法不正确的是( )
| A、霾的形成与PM2.5有直接关系 |
| B、自行车钢架生锈主要是电化学腐蚀所致 |
| C、用加热的方法杀死H7N9禽流感病毒是采用了蛋白质变性原理 |
| D、人类在研究物质微观结构的过程中,扫描隧道显微镜、光学显微镜、电子显微镜先后得到了使用 |
水溶液中能大量共存的一组离子是( )
| A、K+、H+、I-、ClO- |
| B、Na+、Fe3+、SO42-、OH- |
| C、Al3+、NH4+、AlO2-、NO3- |
| D、Mg2+、Ca2+、HCO3-、Br- |
下列有机物中没有同分异构体的是( )
| A、溴乙烷 | B、二溴乙烷 |
| C、已烯 | D、二甲苯 |
下列说法正确的是( )
| A、所有的复分解反应都是非氧化还原反应 |
| B、能与酸反应的氧化物,一定是碱性氧化物 |
| C、同一元素不可能既表现金属性,又表现非金属性 |
| D、以共价键形成的单质中只存在非极性键,以共价键形成的化合物中只存在极性键 |
部分弱酸的电离平衡常数如表,表述肯定正确的是( )
| 弱酸 | H2CO3 | H2SO3 | HClO |
| 电离平衡常数 (25℃) |
K1=4.30×10-7 | K1=1.54×10-2 | K=2.95×10-8 |
| K2=5.61×10-11 | K2=1.02×10-7 |
| A、相同温度时三种溶液的pH关系:Na2CO3>NaClO>Na2SO3 |
| B、ClO-+H2O+CO2→HClO+HCO3- |
| C、2ClO-+SO2+H2O→2HClO+SO32- |
| D、等体积、等物质的量浓度的HClO 和Na2CO3混合后溶液呈碱性 |
化学与社会、生产、生活紧切相关.下列说法正确的是( )
| A、PM2.5颗粒直径约是原子直径的2.5倍 |
| B、淀粉、蔗糖、氨基酸在一定条件都能发生水解反应 |
| C、植物油通常能和氢氧化钠溶液发生反应 |
| D、应该倡议禁止向绿色食品中添加任何化学物质 |
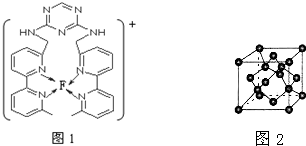 现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期.B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期.B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题: 已知溶液中,还原性为HSO3->I-,氧化性为IO3->I2>SO42-.
已知溶液中,还原性为HSO3->I-,氧化性为IO3->I2>SO42-.