题目内容
 已知溶液中,还原性为HSO3->I-,氧化性为IO3->I2>SO42-.
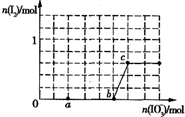
已知溶液中,还原性为HSO3->I-,氧化性为IO3->I2>SO42-.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示.
请回答:
(1)a点处的还原产物是:
(2)当溶液中的I-为0.5mol时,加入的KIO3可能是:
考点:氧化还原反应的计算,离子方程式的有关计算
专题:氧化还原反应专题
分析:还原性HSO-3>I-,首先发生反应:2IO3-+6HSO3-═2I-+6SO42-+6H+,HSO3-反应完毕,继续加入KIO3,由于氧化性IO-3>I2,再发生反应:IO3-+6H++5I-=3H2O+3I2,
(1)结合图中a点碘的量判断发生的反应,所含元素化合价升高的反应物是还原剂,化合价降低的元素被还原,据此解答;由图可知,b点到c点有碘生成,应发生IO3-+6H++5I-=3H2O+3I2;
(2)当溶液中的I-为0.5mol时,有两种情况:
一是只发生反应2IO3-+6HSO3-═2I-+6SO42-+6H+,生成I-为0.5mol,根据碘元素守恒n(KIO3)=n(I-);
二是HSO3-反应完毕后,还发生IO3-+6H++5I-=3H2O+3I2,剩余I-为0.5mol,计算HSO3-反应完毕生成n(I-)、消耗的n(KIO3),进而计算反应IO3-+6H++5I-=3H2O+3I2中消耗的I-、KIO3的物质的量,据此计算;
(1)结合图中a点碘的量判断发生的反应,所含元素化合价升高的反应物是还原剂,化合价降低的元素被还原,据此解答;由图可知,b点到c点有碘生成,应发生IO3-+6H++5I-=3H2O+3I2;
(2)当溶液中的I-为0.5mol时,有两种情况:
一是只发生反应2IO3-+6HSO3-═2I-+6SO42-+6H+,生成I-为0.5mol,根据碘元素守恒n(KIO3)=n(I-);
二是HSO3-反应完毕后,还发生IO3-+6H++5I-=3H2O+3I2,剩余I-为0.5mol,计算HSO3-反应完毕生成n(I-)、消耗的n(KIO3),进而计算反应IO3-+6H++5I-=3H2O+3I2中消耗的I-、KIO3的物质的量,据此计算;
解答:
解:还原性HSO-3>I-,首先发生反应:2IO3-+6HSO3-═2I-+6SO42-+6H+,HSO3-反应完毕,继续加入KIO3,由于氧化性IO-3>I2,再发生反应:IO3-+6H++5I-=3H2O+3I2,
(1)由图可知,a点没有生成碘,故发生反应2IO3-+6HSO3-═2I-+6SO42-+6H+,反应中S元素化合价升高,还原剂是HSO3-,I元素的化合价降低,I元素被还原,所以此处的还原产物是I-,由图可知,b点到c点由于生成I2,故发生反应:IO3-+6H++5I-=3H2O+3I2,
故答案为:I-;IO3-+6H++5I-=3H2O+3I2;
(2)当溶液中的I-为0.5mol时,有两种情况:
一是只发生反应2IO3-+6HSO3-═2I-+6SO42-+6H+,生成I-为0.5mol,根据碘元素守恒n(KIO3)=n(I-)=0.5mol;
二是HSO3-反应完毕后,还发生IO3-+6H++5I-=3H2O+3I2,剩余I-为0.5mol,3molNaHSO3消耗1molKIO3、生成1molI-,故反应IO3-+6H++5I-=3H2O+3I2中消耗的I-为1mol-0.5mol=0.5mol,消耗KIO3的物质的量为0.5mol×
=0.1mol,故共加入的KIO3为1mol+0.1mol=1.1mol,
故答案为:0.5或1.1.
(1)由图可知,a点没有生成碘,故发生反应2IO3-+6HSO3-═2I-+6SO42-+6H+,反应中S元素化合价升高,还原剂是HSO3-,I元素的化合价降低,I元素被还原,所以此处的还原产物是I-,由图可知,b点到c点由于生成I2,故发生反应:IO3-+6H++5I-=3H2O+3I2,
故答案为:I-;IO3-+6H++5I-=3H2O+3I2;
(2)当溶液中的I-为0.5mol时,有两种情况:
一是只发生反应2IO3-+6HSO3-═2I-+6SO42-+6H+,生成I-为0.5mol,根据碘元素守恒n(KIO3)=n(I-)=0.5mol;
二是HSO3-反应完毕后,还发生IO3-+6H++5I-=3H2O+3I2,剩余I-为0.5mol,3molNaHSO3消耗1molKIO3、生成1molI-,故反应IO3-+6H++5I-=3H2O+3I2中消耗的I-为1mol-0.5mol=0.5mol,消耗KIO3的物质的量为0.5mol×
| 1 |
| 5 |
故答案为:0.5或1.1.
点评:本题是一道有关氧化还原反应的综合题,考查角度广,难度中等,要求学生具有分析和解决问题的能力.

练习册系列答案
相关题目
对于在恒温恒容容器中进行的反应A(g)+2B(g)?3C(g)+D(g),以下不能说明已达平衡状态的是
( )
( )
| A、反应容器中,压强不随时间改变而改变 |
| B、单位时间内生成3n mol C的同时生成n mol A |
| C、反应容器中,混合气体的平均相对分子质量不再改变 |
| D、反应容器中的气体密度不随时间变化 |
揭示下列变化的离子方程式正确的是( )
| A、明矾用于净水:Al3++3H2O═Al(OH)3↓+3H+ |
| B、钢铁吸氧腐蚀的负极反应:Fe-3e-═Fe3+ |
| C、向明矾溶液中加入少量氢氧化钡溶液:Al3++SO42-+Ba2++3OH-═BaSO4↓+Al(OH)3↓ |
D、苯酚钠饱和溶液中通入少CO2: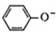 +CO2+H2O→ +CO2+H2O→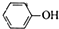 +HCO3- +HCO3- |
将Cl2通入100mL NaOH溶液中充分反应,生成0.1mol的NaCl,下列说法正确的是( )
| A、反应后溶液中ClO-的个数为0.1NA |
| B、原NaOH浓度为1mol/L |
| C、参加反应的氯气分子为0.1NA |
| D、转移电子为0.2NA |