题目内容
下列说法正确的是( )
| A、所有的复分解反应都是非氧化还原反应 |
| B、能与酸反应的氧化物,一定是碱性氧化物 |
| C、同一元素不可能既表现金属性,又表现非金属性 |
| D、以共价键形成的单质中只存在非极性键,以共价键形成的化合物中只存在极性键 |
考点:酸、碱、盐、氧化物的概念及其相互联系,化学键,化学基本反应类型
专题:基本概念与基本理论
分析:A.复分解反应中一定没有元素的化合价变化;
B.能与酸反应的氧化物,可能为两性氧化物等;
C.周期表中处于金属与非金属交界处的元素,既有金属性也有非金属性;
D.以共价键形成的化合物中,可能含极性键和非极性键.
B.能与酸反应的氧化物,可能为两性氧化物等;
C.周期表中处于金属与非金属交界处的元素,既有金属性也有非金属性;
D.以共价键形成的化合物中,可能含极性键和非极性键.
解答:
解:A.复分解反应中一定没有元素的化合价变化,则所有的复分解反应都是非氧化还原反应,故A正确;
B.能与酸反应的氧化物,可能为两性氧化物等,如氧化铝为两性氧化物与酸反应,过氧化钠也与酸反应,故B错误;
C.周期表中处于金属与非金属交界处的元素,既有金属性也有非金属性,如Si为良好的半导体材料,有金属性和非金属性,故C错误;
D.以共价键形成的化合物中,可能含极性键和非极性键,如H-O-O-H中含极性键和非极性键,为共价化合物,故D错误;
故选A.
B.能与酸反应的氧化物,可能为两性氧化物等,如氧化铝为两性氧化物与酸反应,过氧化钠也与酸反应,故B错误;
C.周期表中处于金属与非金属交界处的元素,既有金属性也有非金属性,如Si为良好的半导体材料,有金属性和非金属性,故C错误;
D.以共价键形成的化合物中,可能含极性键和非极性键,如H-O-O-H中含极性键和非极性键,为共价化合物,故D错误;
故选A.
点评:本题考查较综合,涉及氧化还原反应、物质分类、元素性质与周期表的位置关系、化学键与物质分类等,选项B为解答的易错点,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
揭示下列变化的离子方程式正确的是( )
| A、明矾用于净水:Al3++3H2O═Al(OH)3↓+3H+ |
| B、钢铁吸氧腐蚀的负极反应:Fe-3e-═Fe3+ |
| C、向明矾溶液中加入少量氢氧化钡溶液:Al3++SO42-+Ba2++3OH-═BaSO4↓+Al(OH)3↓ |
D、苯酚钠饱和溶液中通入少CO2: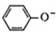 +CO2+H2O→ +CO2+H2O→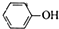 +HCO3- +HCO3- |
将Cl2通入100mL NaOH溶液中充分反应,生成0.1mol的NaCl,下列说法正确的是( )
| A、反应后溶液中ClO-的个数为0.1NA |
| B、原NaOH浓度为1mol/L |
| C、参加反应的氯气分子为0.1NA |
| D、转移电子为0.2NA |
纳米Cu2O是一种用途广泛的光电材料,可用如下两种电化学装置制备这种材料,下列有关说法中正确的是( )


| A、阳极上的电极反应均为2Cu-2e-+2OH-═Cu2O+H2O |
| B、工作过程中两个装置内溶液的pH均减小 |
| C、两个装置内阴离子均移向铜电极 |
| D、阴极上开始时均有氢气生成 |
已知:4NH3+5O2=4NO+6H2O,若反应速率分别用v NH3、v O2、vNO、v H2O(mol/L?min)表示,则正确的关系是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
 如图是甲醇/过氧化氢燃料电池内部结构示意图.工作时,甲醇和过氧化氢分别进入燃料电池的燃料腔和氧化剂腔,在各自催化剂的作用下发生反应,并向外界输出电能.下列说法不正确的是( )
如图是甲醇/过氧化氢燃料电池内部结构示意图.工作时,甲醇和过氧化氢分别进入燃料电池的燃料腔和氧化剂腔,在各自催化剂的作用下发生反应,并向外界输出电能.下列说法不正确的是( )| A、该电池的正极反应式:H2O2+2H++2e-═2H2O |
| B、燃料腔中的多孔石墨电极为该燃料电池的负极,负极产生的H+通过质子交换膜流向正极 |
| C、电池工作时,1mol甲醇被氧化有6 mol电子转移 |
| D、电路中的电子经正极、负极、质子交换膜后再回到正极,形成闭合回路 |