题目内容
(1)分别取W g钠、铁、铝与足量盐酸反应,在相同条件下产生氢气的体积比是
(2)若产生相同物质的量的氢气,所需钠、铁、铝的质量之比为
(3)分别取0.2mol金属钠、铁、铝分别投入到10mL 1mol/L的盐酸中,在标准状况下,产生氢气的体积分别为V1,V2,V3,则V1,V2,V3大小顺序是 .
(2)若产生相同物质的量的氢气,所需钠、铁、铝的质量之比为
(3)分别取0.2mol金属钠、铁、铝分别投入到10mL 1mol/L的盐酸中,在标准状况下,产生氢气的体积分别为V1,V2,V3,则V1,V2,V3大小顺序是
考点:化学方程式的有关计算
专题:计算题
分析:题中涉及到的化学方程式有①2Na+2HCl=2NaCl+H2↑,②Fe+2HCl=FeCl2+H2↑,③2Al+6HCl=2AlCl3+3H2,④2Na+2H2O=2NaOH+H↑,根据各反应物的物质的量结合化学方程式计算.
解答:
解:(1)Wg钠、铁、铝与足量盐酸反应,则:
2Na+2HCl=2NaCl+H2↑、
46g 1mol
Wg x
故x=
=
mol
Fe+2HCl=FeCl2+H2↑,
56g 1mol
Wg y
故y=
=
mol
2Al+6HCl=AlCl3+3H2↑,
54g 3mol
Wg z
故z=
=
mol
故Wg钠、铁、铝与足量盐酸反应,相同条件下产生氢气的体积比=
mol:
mol:
mol=
:
:
,
故答案为:
:
:
;
(2)产生相同物质的量的氢气,设氢气为3mol,则:
2Na+2HCl=2NaCl+H2↑、Fe+HCl=FeCl2+H2↑、2Al+6HCl=AlCl3+3H2↑,
6mol 3mol 3mol 3mol 2mol 3mol
故所需钠、铁、铝的物质的量之比=6mol:3mol:2mol=6:3:2,
则质量比=6×23:3×56::2×27=23:28:9,
故答案为:23:28:9;
(3)10mL 1mol/L的盐酸的物质的量为0.01L×1mol/L=0.01mol,若将0.2mol金属钠、铝、铁分别投入到10mL 1mol/L的盐酸中,可知三种金属都过量,盐酸不足,完全反应,但金属钠能与水反应继续生成氢气,所以钠反应生成氢气最多,铝、铁反应生成氢气一样多,故答案为:V1>V2=V3.
2Na+2HCl=2NaCl+H2↑、
46g 1mol
Wg x
故x=
| Wg×1mol |
| 46g |
| W |
| 46 |
Fe+2HCl=FeCl2+H2↑,
56g 1mol
Wg y
故y=
| Wg×1mol |
| 56g |
| W |
| 56 |
2Al+6HCl=AlCl3+3H2↑,
54g 3mol
Wg z
故z=
| Wg×3mol |
| 54g |
| W |
| 18 |
故Wg钠、铁、铝与足量盐酸反应,相同条件下产生氢气的体积比=
| W |
| 46 |
| W |
| 56 |
| W |
| 18 |
| 1 |
| 23 |
| W |
| 28 |
| 1 |
| 9 |
故答案为:
| 1 |
| 23 |
| W |
| 28 |
| 1 |
| 9 |
(2)产生相同物质的量的氢气,设氢气为3mol,则:
2Na+2HCl=2NaCl+H2↑、Fe+HCl=FeCl2+H2↑、2Al+6HCl=AlCl3+3H2↑,
6mol 3mol 3mol 3mol 2mol 3mol
故所需钠、铁、铝的物质的量之比=6mol:3mol:2mol=6:3:2,
则质量比=6×23:3×56::2×27=23:28:9,
故答案为:23:28:9;
(3)10mL 1mol/L的盐酸的物质的量为0.01L×1mol/L=0.01mol,若将0.2mol金属钠、铝、铁分别投入到10mL 1mol/L的盐酸中,可知三种金属都过量,盐酸不足,完全反应,但金属钠能与水反应继续生成氢气,所以钠反应生成氢气最多,铝、铁反应生成氢气一样多,故答案为:V1>V2=V3.
点评:本题考查了金属与酸反应的计算,中等难度,注意钠性质的特殊性,即过量钠和水反应产生氢气,易被忽落.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
下列说法正确的是(NA表示阿伏加德罗常数)( )
| A、常温常压下,1mol氮气含有NA个氮分子 |
| B、标准状况下,22.4LNO和11.2L氧气混合,气体的分子总数约为1.5NA个 |
| C、常温下,18g重水所含中子数为10NA个 |
| D、31g白磷分子中,含有的共价单键数目是NA个 |
对下列实验现象及其解释不正确的是( )
| A、金属钠在Cl2中燃烧产生白烟,这是因为产生的NaCl固体颗粒分散到空气中所致 | ||||||||||||
| B、把烧红的铁丝放在放在氧气中,发出耀眼白光,产生黑色固体,这是因为该反应放热多,生成的Fe3O4为黑色 | ||||||||||||
| C、单质Mg、Al与O2反应,条件不同,可能产生不同的产物 | ||||||||||||
D、镁带在空气中点燃发出耀眼光芒,并发生三个反应:2Mg+O2
|
阿司匹林是一种常用的解热镇痛药,当它在碱性条件下完全水解时,可得到的全部产物有( )
| A、2种 | B、3种 | C、4种 | D、5种 |

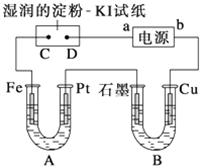 电解装置如图所示.图中B装置盛1L 2mol?L-1的Na2SO4溶液,A装置中盛1L 2mol?L-1AgNO3溶液.通电后,湿润的淀粉KI试纸的C端变蓝色.电解一段时间后,试回答:
电解装置如图所示.图中B装置盛1L 2mol?L-1的Na2SO4溶液,A装置中盛1L 2mol?L-1AgNO3溶液.通电后,湿润的淀粉KI试纸的C端变蓝色.电解一段时间后,试回答: