题目内容
元代青花瓷的制作原料采用瓷土加高岭土[主要成分Al2Si2O5(OH)x]的“二元配方”,青花瓷釉料的成分主要是钾长石(KAlSi3O8),在1300℃左右高温一次烧成的釉可形成精美的青花瓷

(1)下列说法正确的是
A.高岭土化学式中x=2
B.钾长石能完全溶于盐酸
C.烧制青花瓷的过程中发生了复杂的物理变化,但没有化学变化
D.青花瓷、玻璃、水泥都属于硅酸盐产品
(2)工业上可利用海边石英砂生产粗硅,其主要原理:SiO2+2C
Si(粗)+2CO↑.
工业上可通过如图所示流程由粗硅进一步制纯硅:
①反应a的化学方程式为Si(粗)+3HCl(g)
SiHCl3(l)+H2(g),反应b的化学方程式为
②以上工艺中可循环使用的物质是 .
③若上述两步反应中硅元素的利用率均为80%,制粗硅时有10%的SiO2转化为SiC,则生产25.2吨纯硅需纯度为75%石英砂 吨.

(1)下列说法正确的是
A.高岭土化学式中x=2
B.钾长石能完全溶于盐酸
C.烧制青花瓷的过程中发生了复杂的物理变化,但没有化学变化
D.青花瓷、玻璃、水泥都属于硅酸盐产品
(2)工业上可利用海边石英砂生产粗硅,其主要原理:SiO2+2C
| ||
工业上可通过如图所示流程由粗硅进一步制纯硅:
①反应a的化学方程式为Si(粗)+3HCl(g)
| ||
②以上工艺中可循环使用的物质是
③若上述两步反应中硅元素的利用率均为80%,制粗硅时有10%的SiO2转化为SiC,则生产25.2吨纯硅需纯度为75%石英砂
考点:硅和二氧化硅
专题:碳族元素
分析:(1)A.依据化合价代数和为0计算解答;
B.钾长石与盐酸反应生成氯化钾、氯化铝和硅酸;
C.陶瓷烧制过程中即发生里物理变化,又发生了化学变化;
D.硅酸盐产品是以含硅物质为原料经加热制成的主要包括:水泥、玻璃、陶瓷;
(2)①依据原子个数和目标产物硅写成化学方程式;
②依据流程图分析物质在反应过程中又生成的物质可以循环利用;
③根据石英砂和硅之间关系式计算.
B.钾长石与盐酸反应生成氯化钾、氯化铝和硅酸;
C.陶瓷烧制过程中即发生里物理变化,又发生了化学变化;
D.硅酸盐产品是以含硅物质为原料经加热制成的主要包括:水泥、玻璃、陶瓷;
(2)①依据原子个数和目标产物硅写成化学方程式;
②依据流程图分析物质在反应过程中又生成的物质可以循环利用;
③根据石英砂和硅之间关系式计算.
解答:
解:(1)A.高岭土Al2Si2O5(OH)x中,铝为+3价,硅为+4价,氧为-2价,依据代数和为0,可知氢氧根离子个数为4,故A错误;
B.钾长石与盐酸反应生成氯化钾、氯化铝和硅酸,硅酸不溶于盐酸,故B错误;
C.陶瓷烧制过程中即发生里物理变化,又发生了化学变化,故C错误;
D.水泥、玻璃、陶瓷都是传统无机非金属材料,主要是硅酸盐产品,制备原料都需要用到含硅元素的物质,故D正确;
故选:D;
(2)①SiHCl3与发生还原反应生成硅和氯化氢,化学方程式:SiHCl3+H2
Si+3HCl;
故答案为:SiHCl3+H2
Si+3HCl;
②氯化氢和氢气在粗硅提纯中参加反应,反应后又生成氯化氢和氢气,所以可以循环使用;
故答案为:HCl、H2;
③设需要生产25.2吨纯硅需纯度为75%石英砂m吨,则:
SiO2~SiCl4~Si(纯)
60 28
m吨×75%×(1-10%)×80%×80% 25.2吨
所以m吨×75%×(1-10%)×80%×80%:25.2吨=60:28
解得m=125t,
故答案为:125.
B.钾长石与盐酸反应生成氯化钾、氯化铝和硅酸,硅酸不溶于盐酸,故B错误;
C.陶瓷烧制过程中即发生里物理变化,又发生了化学变化,故C错误;
D.水泥、玻璃、陶瓷都是传统无机非金属材料,主要是硅酸盐产品,制备原料都需要用到含硅元素的物质,故D正确;
故选:D;
(2)①SiHCl3与发生还原反应生成硅和氯化氢,化学方程式:SiHCl3+H2
| ||
故答案为:SiHCl3+H2
| ||
②氯化氢和氢气在粗硅提纯中参加反应,反应后又生成氯化氢和氢气,所以可以循环使用;
故答案为:HCl、H2;
③设需要生产25.2吨纯硅需纯度为75%石英砂m吨,则:
SiO2~SiCl4~Si(纯)
60 28
m吨×75%×(1-10%)×80%×80% 25.2吨
所以m吨×75%×(1-10%)×80%×80%:25.2吨=60:28
解得m=125t,
故答案为:125.
点评:本题考查了粗硅的提纯,题目难度不大,明确二氧化硅和硅的性质是解题关键,注意对基础知识的积累.

练习册系列答案
相关题目
某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是( )


| A、a为正极,b为负极;NaClO和NaCl |
| B、a为负极,b为正极;NaClO和NaCl |
| C、a为阳极,b为阴极;HClO和NaCl |
| D、a为阴极,b为阳极;HClO和NaCl |
在一定条件下,向5L密闭容器中充入2mol A气体和1mol B气体,发生可逆反应:2A(g)+B(g)?2C(g),达到平衡时容器内B的物质的量浓度为0.1mol/L,则A的转化率为( )
| A、67% | B、50% |
| C、25% | D、5% |
下列说法合理的是( )
| A、每天应保证摄入一定量的蔬菜和粗粮,是因为它们含有一定量的纤维素,用以补充营养食物中淀粉的不足 |
| B、厨房中用油不能放在盆中长时间与空气接触而被氧化,应放入大塑料桶中加盖密封保存 |
| C、人体中必需的氨基酸叫必需氨基酸 |
| D、加碘盐和铁强化酱油都有利于人体对微量元素的均衡吸收,不容易导致体内微量元素的过量 |
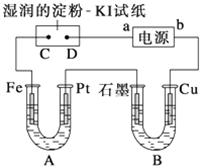 电解装置如图所示.图中B装置盛1L 2mol?L-1的Na2SO4溶液,A装置中盛1L 2mol?L-1AgNO3溶液.通电后,湿润的淀粉KI试纸的C端变蓝色.电解一段时间后,试回答:
电解装置如图所示.图中B装置盛1L 2mol?L-1的Na2SO4溶液,A装置中盛1L 2mol?L-1AgNO3溶液.通电后,湿润的淀粉KI试纸的C端变蓝色.电解一段时间后,试回答: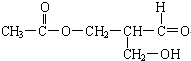 在有机物分子中碳原子所连的4个原子或原子团均不相同时,该碳原子叫手性碳原子,以*C表示.而且,该有机化合物具有光学活性.下列有机物是否具有光学活性?
在有机物分子中碳原子所连的4个原子或原子团均不相同时,该碳原子叫手性碳原子,以*C表示.而且,该有机化合物具有光学活性.下列有机物是否具有光学活性?