题目内容
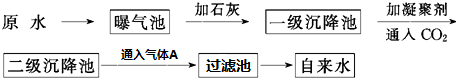
17.化学与生活息息相关,下列说法错误的是( )| A. | 用SO2漂白过的草帽辫日久会变色 | |
| B. | 硅胶多孔,常用作食品干燥剂和催化剂的载体 | |
| C. | 用灼烧和闻气味的方法区别棉织物和纯毛织物 | |
| D. | 氯气处理饮用水,在夏季的杀菌效果比在冬季好 |
分析 A.二氧化硫具有漂白性,是二氧化硫结合有色物质形成不稳定的无色物质,加热会恢复原来的颜色;
B.硅胶能做干燥剂和催化剂的载体;
C.纯毛织物含有蛋白质,灼烧时有烧焦羽毛的气味;
D.氯气在高温下溶解度小.
解答 解:A.二氧化硫具有漂白性,是二氧化硫结合有色物质形成不稳定的无色物质,加热会恢复原来的颜色,用SO2漂白过的草帽辫不能长久持白,故A正确;
B.硅胶多孔,吸附能力很强,所以硅胶用作干燥剂、吸附剂,也可用作催化剂载体,故B正确;
C.纯毛织物含有蛋白质,灼烧时有烧焦羽毛的气味,纯棉织物在灼烧时的气味不同,故可以区别,故C正确;
D.温度越高,气体的溶解度越低,故用氯气给自来水消毒时,夏天的消毒效果比冬天差,故D错误;
故选:D.
点评 本题考查了物质的性质也用途,性质决定用途,明确二氧化硫漂白原理、蛋白质、硅胶、氯气的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
7.甲小组以H2O2分解为例,探究外界条件对反应速率的影响.在常温下按照下表所示的方案完成实验.
(1)实验①和②的目的是浓度对化学反应速率的影响.进行实验时没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进方法是相同温度的水浴加热或加入相同量的MnO2等催化剂(填一种即可).
(2)利用实验②和③可知加入FeCl3溶液可以催化H2O2分解,已知FeCl3溶液中含有H2O、Fe3+和Cl-三种粒子,为探究哪种粒子具有催化作用,有如下三种猜想:
猜想1:真正催化分解H2O2的是FeCl3溶液中的H2O
猜想2:真正催化分解H2O2的是FeCl3溶液中的Fe3+
猜想3:真正催化分解H2O2的是FeCl3溶液中的Cl-
你认为最不可能的是猜想1;理由是因过氧化氢溶液中自身有水,可见水不是催化剂.
(3)同学们又对余下的两种猜想进行了实验探究,请你帮助他们填写下表:
乙小组通过Na2S2O3与0.1mol•L-1 H2SO4反应溶液浑浊的时间,研究外界条件对化学反应速率的影响.设计实验如下:
(4)已知:反应中除生成淡黄色沉淀外还会生成刺激性气味的气体,写出反应离子方程式:S2O32-+2H+=S↓+SO2↑+H2O;
(5)若同时选择实验①②、实验①③,测定混合液变浑浊的时间,可分别探究Na2S2O3浓度和H2SO4的浓度对化学反应速率的影响,则表中b为10mL.
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL 2% H2O2溶液 | 无 |
| ② | 10mL 5% H2O2溶液 | 无 |
| ③ | 10mL 5% H2O2溶液 | 1mL 0.1mol•L-1 FeCl3溶液 |
(2)利用实验②和③可知加入FeCl3溶液可以催化H2O2分解,已知FeCl3溶液中含有H2O、Fe3+和Cl-三种粒子,为探究哪种粒子具有催化作用,有如下三种猜想:
猜想1:真正催化分解H2O2的是FeCl3溶液中的H2O
猜想2:真正催化分解H2O2的是FeCl3溶液中的Fe3+
猜想3:真正催化分解H2O2的是FeCl3溶液中的Cl-
你认为最不可能的是猜想1;理由是因过氧化氢溶液中自身有水,可见水不是催化剂.
(3)同学们又对余下的两种猜想进行了实验探究,请你帮助他们填写下表:
| 实验步骤 | 实验现象 | 实验结论 |
| 向盛有5mL 15%的H2O2溶液的试管中加入少量的HCl,然后把带火星的木条伸入试管中. | 无明显现象 | ①Cl-不具有催化作用或猜想3不正确 |
| 向盛有5mL 15%的H2O2溶液的试管中加入少量的FeCl3固体,然后把带火星的木条伸入试管中. | ②试管中有大量气泡产生,带火星的木条复燃 | ③Fe3+具有催化作用或猜想2正确 |
| 实验编号 | 温度/℃ | Na2S2O3 | V(H2SO4)/mL | V(H2O)/mL | |
| c/mol•L-1 | V/mL | ||||
| ① | 25 | 0.1 | 5.0 | 10.0 | a |
| ② | 25 | 0.1 | 10.0 | 10.0 | 0 |
| ③ | 25 | 0.1 | 5.0 | 5.0 | b |
(5)若同时选择实验①②、实验①③,测定混合液变浑浊的时间,可分别探究Na2S2O3浓度和H2SO4的浓度对化学反应速率的影响,则表中b为10mL.
5. 常温下,向20.00mL0.1000mol•L-1的醋酸溶液中逐滴加入0.1000mol•L-1的NaOH溶液,pH随NaOH溶液体积的变化如图所示.下列说法不正确的是( )
常温下,向20.00mL0.1000mol•L-1的醋酸溶液中逐滴加入0.1000mol•L-1的NaOH溶液,pH随NaOH溶液体积的变化如图所示.下列说法不正确的是( )
 常温下,向20.00mL0.1000mol•L-1的醋酸溶液中逐滴加入0.1000mol•L-1的NaOH溶液,pH随NaOH溶液体积的变化如图所示.下列说法不正确的是( )
常温下,向20.00mL0.1000mol•L-1的醋酸溶液中逐滴加入0.1000mol•L-1的NaOH溶液,pH随NaOH溶液体积的变化如图所示.下列说法不正确的是( )| A. | 在反应过程中,c(Na+)+c(H+)=c(CH3COO-)+c(OH-) | |
| B. | pH=5时,c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | pH=6时,c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1000 mol•Lˉ1 | |
| D. | pH=7时,消耗NaOH溶液的体积小于20.00mL |
12.X、Y、Z、W为原子序数依次增大的短周期主族元素,其最外层电子数之和为20,X是第二周期元素,Z原子最外层电子数既是X原子内层电子总数的3倍,又是Y原子最外层电子数的2倍,下列说法正确的是( )
| A. | 原子半径:W>Z>Y | |
| B. | 工业上通过电解Y的无水盐来制备Y的单质 | |
| C. | 最高价氧化物对应水化物的酸性:W>Z>X | |
| D. | 氧元素分别与X、Y、Z、W形成的化合物都不止一种 |
9.设NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 等质量的 O2和O3在相同条件下所占的体积相同 | |
| B. | 电解精炼铜时,若转移6.02X1023个电子,则阳极溶解32g铜 | |
| C. | 1molCl2溶于足量水中,转移的电子数为NA | |
| D. | 2L0.2mol•L-1硝酸与适量铁恰好完全反应(还原产物为NO),生成NO的分子数目为NA |
7.下列离子方程式中,不正确的是( )
| A. | 将SO2气体通入三氯化铁溶液中:SO2+2Fe3++2H2O=2Fe2++SO42-+4H+ | |
| B. | 铜和三氯化铁溶液反应:Cu+Fe3+=Fe2++Cu2+ | |
| C. | 实验室制取氯气:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O | |
| D. | 金属铝投入到NaOH溶液中:2Al+2OH-+2H2O=2AlO2-+3H2↑ |