题目内容
6.Q、R、X、Y、Z是短周期元素,原子序数依次增大.Q的基态原子最外层s轨道和p轨道电子数相等;R的一种氢化物是常见的碱性气体;X在同周期元素中,其氧化物的水化物是最强的碱;Y的一种氧化物能使品红溶液褪色;Z的最高价氧化物的水化物是最强的酸.请回答下列问题:
(1)R位于元素周期表中第二周期,第VA族.
(2)Q形成的最高价氧化物分子是非极性(填“极性”或“非极性”)分子,中心原子的杂化轨道类型是sp.
(3)Y、Z的氢化物中,稳定性较强的是HCl(填氢化物的化学式).
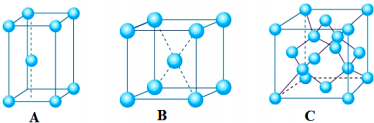
(4)X单质的晶体的晶胞示意图是B(填字母编号).
(5)Y的最高价含氧酸根Y2O82-中,Y和Y之间有一过氧键,该酸根具有极强的氧化性,在Ag+的催化下,能将酸性介质中的Mn2+氧化成MnO4-,而Y的价态不变,该反应的离子方程式是5S2O82-+2Mn2++8H2O=2MnO4-+10SO42-+16H+.
分析 Q、R、X、Y、Z是短周期元素,原子序数依次增大,
R的一种氢化物是常见的碱性气体,其氢化物应为NH3,则R为N元素;
Q的基态原子最外层s轨道和p轨道电子数相等,且Q的原子序数小于R的,则Q的最外层电子排布式为2s22p2,则Q为C元素;
X在同周期元素中,其氧化物的水化物是最强的碱,X的原子序数大于R的,X为第三周期元素,则X为Na元素;
Y的一种氧化物能使品红溶液褪色,此氧化物为SO2,则Y为S元素;
Z的最高价氧化物的水化物是最强的酸,此酸为HClO4,则Z为Cl元素,
据此解答.
解答 解:Q、R、X、Y、Z是短周期元素,原子序数依次增大,
R的一种氢化物是常见的碱性气体,其氢化物应为NH3,则R为N元素;
Q的基态原子最外层s轨道和p轨道电子数相等,且Q的原子序数小于R的,则Q的最外层电子排布式为2s22p2,则Q为C元素;
X在同周期元素中,其氧化物的水化物是最强的碱,X的原子序数大于R的,X为第三周期元素,则X为Na元素;
Y的一种氧化物能使品红溶液褪色,此氧化物为SO2,则Y为S元素;
Z的最高价氧化物的水化物是最强的酸,此酸为HClO4,则Z为Cl元素,
(1)由上分析知R为N元素,属于第二周期第VA族元素,故答案为:二;VA;
(2)Q形成的最高价氧化物为CO2,属于分子晶体,CO2分子中C原子电子对数为$\frac{1}{2}$(4+0)=2,杂化方式为sp杂化,故答案为:非极性;sp;
(3)Y、Z的氢化物为H2S、HCl,元素非金属性越强,其氢化物稳定性越强,非金属性Cl>S,所以HCl稳定性强,故答案为:HCl;
(4)Na晶体有体心立方堆积,六方最密堆积,立方面心最密堆积三种排列方式,B为体心立方堆积,故答案为:B;
(5)S的最高价含氧酸根S2O82-具有极强的氧化性,在Ag+的催化下,能将酸性介质中的Mn2+氧化成MnO4-,而S的价态不变,该反应的离子方程式是 5S2O82-+2Mn2++8H2O=2MnO4-+10SO42-+16H+,故答案为:5S2O82-+2Mn2++8H2O=2MnO4-+10SO42-+16H+.
点评 本题考查了原子结构与元素周期律的关系、晶胞的类型等知识点,难度不大,熟练掌握元素周期律是解答此类题目的关键.

| A. | X不一定属于烃的衍生物 | |
| B. | 能与NaHCO3反应的X有3种 | |
| C. | X的某些同分异构体之间可能发生取代反应 | |
| D. | 能与NaOH溶液反应的X都含有相同的官能团 |
| A. | 用SO2漂白过的草帽辫日久会变色 | |
| B. | 硅胶多孔,常用作食品干燥剂和催化剂的载体 | |
| C. | 用灼烧和闻气味的方法区别棉织物和纯毛织物 | |
| D. | 氯气处理饮用水,在夏季的杀菌效果比在冬季好 |
 一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )
一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )| A. | NaCl是非电解质 | |
| B. | NaCl溶液是电解质 | |
| C. | NaCl在水溶液中电离出了可以自由移动的离子 | |
| D. | 固体NaCl中没有离子 |
| A. |  | B. |  | ||
| C. |  向稀醋酸中加入醋酸钠溶液 | D. |  稀释苏打溶液 |
| A. | 标准状况下,22.4 L水中含有的水分子数为NA | |
| B. | 4.0 g NaOH固体溶于100 mL水中,得到1 mol/L的 NaOH溶液 | |
| C. | 常温、常压下,22 g CO2中含有的氧原子数为NA | |
| D. | 0.5 mol/L Na2SO4溶液中,含有的离子总数为1.5NA |
| A. | 高纯硅广泛用于制作光导纤维 | |
| B. | 将SO2通入到BaCl2溶液中可生成白色沉淀 | |
| C. | 向AlCl3溶液中滴加氨水,产生白色沉淀,再加过量的NaHSO4溶液,沉淀消失 | |
| D. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 |
| A. | 某醋酸溶液的pH=a,将此溶液稀释10倍后,溶液的pH=b,则b=a+1 | |
| B. | 某溶液由水电离的c(OH-)=1.0x10-13mol/L,则此溶液一定显酸性 | |
| C. | 将pH=4的醋酸稀释1000倍,溶液的pH=7 | |
| D. | pH=13的强碱溶液和pH=2的强酸溶液混合,若所得溶液的pH=7,则强碱与强酸的体积比是1:10 |